The final launch of the Allmultimedia.org will take place on February 24, 2026
(shortly after the 2026 Winter Olympics).
Helium
Z Multimediaexpo.cz
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Není-li uvedeno jinak, jsou použity jednotky SI a STP. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Obsah |
Základní fyzikálně - chemické vlastnosti
Bezbarvý plyn, bez chuti a zápachu, chemicky zcela inertní - helium vytváří pouze jednu chemickou sloučeninu a to s fullereny. Ve vodě je velmi málo rozpustné 8,8 ml He v 1000 ml vody. Helium a i ostatní vzácné plyny mají malý elektrický odpor a dobře vedou elektrický proud. Toho se využívá při výrobě výbojek. Helium září intenzivně žlutě.
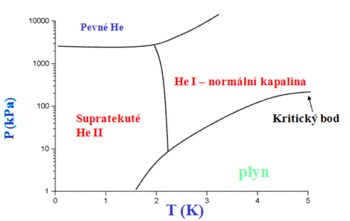
Helium je jediná látka, která při nízkých teplotách a normálním tlaku zůstává kapalná až k teplotě absolutní nuly. Pevné helium lze získat pouze za zvýšeného tlaku. Helium má také ze všech známých látek nejnižší bod varu. Kapalné helium je látka, která vyniká velkým množstvím zajímavých vlastností. Je supratekuté, to znamená, že dokáže bez tření protékat libovolnými předměty a téct bez tření po libovolných předmětech. Je supravodivé, to znamená, že dokáže vést elektrický proud bez ztrát (má neměřitelný elektrický odpor). Tepelná vodivost helia je tři milionkrát větší než u mědi při pokojové teplotě.
Historický vývoj
Samotný objev helia byl učiněn zkoumáním spektra sluneční korony, kdy v roce 1868 při zatmění Slunce francouzský astronom Pierre Janssen objevil neznámé žluté spektrální linie, které byly přiřazeny doposud neznámému prvku, pojmenovaném po starořeckém bohu Slunce, Héliovi. Teprve v roce 1895 se britskému chemikovi Williamu Ramsayovi podařilo izolovat plynné helium na Zemi.
Výskyt v přírodě
Helium je na Zemi přítomno jen velmi vzácně. V zemské atmosféře se vyskytuje jen ve vyšších vrstvách a díky své mimořádně nízké hmotnosti postupně z atmosféry vyprchává do meziplanetárního prostoru. Poprvé bylo helium izolováno z minerálu smolince. V menším množství až 9% se nachází v zemním plynu, z něhož se také získává vymrazováním. Vzácně vyvěrá helium i trhlinami v zemi, nejznámější oblasti těchto vývěrů leží ve Skalistých horách v USA a v Kanadě. Předpokládá se, že veškeré toto helium je produktem jaderného rozpadu prvků v zemské kůře. Ve vesmírném měřítku je helium druhým nejvíce zastoupeným prvkem. Vyskytuje se především ve všech svítících hvězdách, kde je jedním z mezistupňů termonukleární syntézy, jež je podle současných teorií základním energetických zdrojem ve Vesmíru. Tvoří přibližně 25% hmoty okolního pozorovatelného Vesmíru.
Získávání

- Od roku 1917 se v Severní Americe získává helium z ložisek zemního plynu. Od methanu a ostatních plynů se odděluje frakční destilací.
- Další možnost je zahřívat minerály, ve kterých se helium vyskytuje, teplotou okolo 1 200 °C. K takovým minerálům patří cleveit, monazit a thorianit. Plyny, které se uvolňují z minerálů, je nutno od sebe oddělit, aby bylo možno získat čisté helium.
Využití
Vzhledem ke své extrémně nízké hustotě a inertnímu chování se helium používá k plnění balónů a vzducholodí jako náhrada hořlavého vodíku. Značnou nevýhodou je zde ovšem jeho poměrně vysoká cena. Navíc má atom helia velmi malý průměr, snadno difunduje i skrze pevné materiály a dochází tak ke ztrátám. Směsí helia, kyslíku a dusíku se plní tlakové láhve s dýchací směsí, určenou pro potápění do velkých hloubek. Na rozdíl od dusíku totiž ani pod velkým tlakem nezpůsobuje tzv. hloubkové opojení, takže potápěč je schopen pracovat ve velkých hloubkách i přes 300 metrů. Zároveň omezuje vznik otravy kyslíkem a současně zmenšuje riziko kesonové nemoci, která vzniká při rychlém výstupu potápěče na hladinu uvolněním bublinek plynného dusíku v krvi s možností mechanického poškození různých tkání. Helium se také používá jako nosný plyn pro kapilární plynovou chromatografii s hmotově spektrometrickou detekcí. Další aplikací v oboru analytické chemie je rentgenová fluorescence, kde tvoří ochrannou atmosféru mezi zdrojem záření a vzorkem a zabraňuje tak pohlcování fotonů rentgenového záření argonem ze vzduchu. Mimořádně nízká teplota varu předurčuje kapalné helium jako jedno ze základních médií pro kryogenní techniky, především pro výzkum i praktické využití supravodivosti a supratekutosti různých materiálů. Helium se ve směsi s neonem používá k plnění reklamních osvětlovačů, obloukových lamp a doutnavek. Helium má intenzivně žlutou barvu. Nízká viskozita je důvodem pro použití hélia ve stirlingově motoru.
Sloučeniny
He@C60 je jediná doposud známá sloučenina hélia, která má velmi zvláštní stavbu. Sférická koule je fulleren a uvnitř v dutině tohoto fullerenu je uzavřen jeden atom helia. Fullereny vznikají kondenzací grafitových par v heliu. Při kondenzaci par ale může dojít k radikálovému mechanismu, jehož výsledkem je tato sloučenina. Páry grafitu nelze normální cestou získat, protože uhlík má teplotu tání více 3500 °C a teplota varu je ještě o mnoho vyšší (přes 4800 °C). Proto se k přípravě par grafitu využívá laseru.
Supratekutost
S heliem je spojen zajímavý fyzikální úkaz, zvaný supratekutost. Kapalné helium se totiž vyskytuje ve dvou formách – helium I při teplotách 2,1768 – 4,21 K a helium II při teplotách nižších než 2,1768 K (tzv. lambda bod). Mezi heliem I a heliem II neexistuje skupenské teplo, což znamená, že tyto dvě formy helia se nemohou vyskytovat v jedné nádobě současně vedle sebe. Nad lambda teplotou se může vyskytovat pouze helium I a pod lambda teplotou pouze helium II. Zatímco helium I se chová jako běžné tekutiny, vykazuje helium II velmi neobvyklé vlastnosti. Především nemá tato kapalina prakticky žádné vnitřní tření, a proto teče nesmírně rychle, ale dokonce díky kapilárnímu jevu přetéká stěny nádob, ve kterých je uchováno a vytéká horním koncem do něj ponořené kapiláry (jev zvaný fontánový efekt), což budí zdání, jako by helium II nebylo vůbec ovlivněno gravitací. Navíc má supratekuté helium největší tepelnou vodivost ze všech doposud známých látek a je tedy supravodivé.
Literatura
- Cotton F.A., Wilkinson J.:Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973
- Holzbecher Z.:Analytická chemie, SNTL, Praha 1974
- Dr. Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- N. N. Greenwood - A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993 ISBN 80-85427-38-9
Externí odkazy
- Periodická soustava a tabulka vlastností prvků [1]
- Chemický vzdělávací portál [2]
- WebElements (anglicky) [3]
- Periodická tabulka prvků [4]
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |