The final launch of the Allmultimedia.org will take place on February 24, 2026
(shortly after the 2026 Winter Olympics).
Dovolená : 23. prosinec 2025 — 29. prosinec 2025
Holidays : December 23, 2025 — December 29, 2025
Ionizační potenciál
Z Multimediaexpo.cz
Ionizační potenciál nebo ionizační energie atomu nebo molekuly je energie potřebná k odtržení jednoho elektronu z izolovaného, plynného atomu nebo iontu. Obecněji, n-tá ionizační energie je energie potřebná k odtržení n-tého elektronu po odtržení n-1 elektronů. Tato veličina vyjadřuje snahu atomu nebo iontu udržet si elektron, tzn. „sílu“ jakou je elektron vázán v elektronovém obalu. Větší ionizační energie znamená obtížnější odtržení elektronu z atomu.
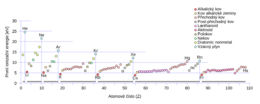
Hodnoty a trendy
Obecně, hodnota ionizačního potenciálu klesá ve skupině periodické tabulky a vzrůstá zleva do prava v rámci jedné periody. Nárust ionizačních energií je značný u sousedicích prvků. Ještě výraznější je v případě, kdy dojde k zaplnění atomového orbitalu. To je způsobeno tím, že po odstranění všech elektronů z orbitalu musíme další elektrony brát z orbitalu, který je blíž k jádru. Na elektrony blízko jádra působí větší elektrostatická síla, proto je jejich odtržení energeticky náročnější.
| Prvek | První | Druhý | Třetí | Čtvrtý | Pátý | Šestý | Sedmý |
|---|---|---|---|---|---|---|---|
| Na | 496 | 4 560 | |||||
| Mg | 738 | 1 450 | 7 730 | ||||
| Al | 577 | 1 816 | 2 881 | 11 600 | |||
| Si | 786 | 1 577 | 3 228 | 4 354 | 16 100 | ||
| P | 1 060 | 1 890 | 2 905 | 4 950 | 6 270 | 21 200 | |
| S | 999,6 | 2 260 | 3 375 | 4 565 | 6 950 | 8 490 | 27 107 |
| Cl | 1 256 | 2 295 | 3 850 | 5 160 | 6 560 | 9 360 | 11 000 |
| Ar | 1 520 | 2 665 | 3 945 | 5 770 | 7 230 | 8 780 | 12 000 |
Hodnotu ionizačního potenciálu lze použít i k určení počtu elektronů ve valenční slupce. Např., pokud odtržení jednoho elektronu vyžaduje 1500 kJ/mol, druhý elektron vyžaduje 6000 kJ/mol a třetí 5000 kJ/mol, můžeme usoudit, že atom obsahuje ve valenční slupce jeden elektron, tzn. jedná se o alkalický kov. První elektron jde odtrhnout velmi snadno, protože vzniklý ion získá konfiguraci příslušného vzácného plynu. Odtržení druhého elektronu je již energeticky velmi náročné, protože vzniklá elektronová konfigurace je energeticky méně výhodná.
Související články
Literatura
- Klikorka J., Hájek B., Votinský J., Obecná a anorganická chemie, 2. vydání, Praha 1989
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |