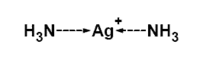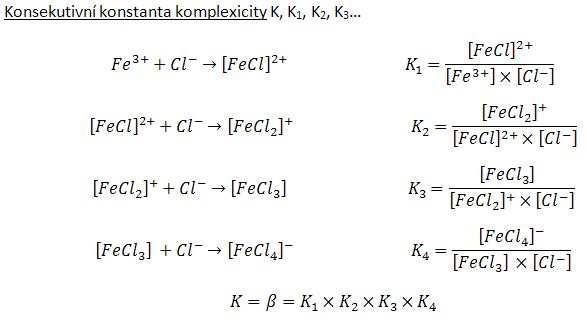Multimediaexpo.cz je již 18 let na českém internetu !!
Komplexní sloučenina
Z Multimediaexpo.cz
Komplexní sloučenina (nebo také koordinační sloučenina) je chemická sloučenina, která obsahuje alespoň jednu koordinačně-kovalentní vazbu. Často se jedná o sloučeniny přechodných kovů s Lewisovými bázemi. Obor chemie, který se zabývá těmito sloučeninami, se nazývá koordinační chemie.
Obsah |
Druhy kovových komplexů
- Klasické komplexy (Wernerovy komplexy) – ligandy jsou vázány ke kovu pomocí volného elektronového páru. Mezi typické ligandy patří H2O, NH3, Cl−, atd. Jde např. o [Co(NH3)6]Cl3
- Organokovové komplexy – jako ligandy zde vystupují organické sloučeniny, např. alkany, alkeny, fosfiny, atd. Jde např. o ferrocen.
- Bioanorganické komplexy – ligandy pocházejí z biologických systémů a obsahují, např. řetězce aminokyselin nebo porfyriny. Jde např. o hemoglobin.
- Klastry – tyto sloučeniny obsahují více atomů kovu, které jsou vázany přímou vazbou kov–kov. Jde např. o Ru3(CO)12.
Koordinační číslo
Pro určení struktury koordinační sloučeniny je důležitá znalost koordinačního čísla, což je počet σ vazeb mezi centrálním atomem a ligandy. Toto číslo odpovídá počtu ligandů pouze v případě jednovazných (monodentátních) ligandů. Hodnota koordinačního čísla běžných komplexů se pohybuje mezi dvěma a devíti, ale např. u lanthanoidů můžeme pozorovat i vyšší koordinační čísla. Maximální koordinační číslo je dáno elektronovou konfigurací centrálního atomu, poměrem velikostí ligandu a centrálního atomu, vlivem náboje centrálního atomu a počtem volných vazebných orbitalů centrálního atomu. Díky elektronovým efektům jako je Jahn-Tellerův efekt jsou některá geometrická uspořádání stabilnější než jejich alternativy, např. pro některé sloučeniny je trigonální prisma výhodnější než oktaedrická struktura. Struktura základních koordinačních čísel je popsána níže, rozsáhlejší článek pojednávající o tomto témto je koordinační číslo. Některé ligandy mají vžité zkratky, které se ve vzorcích používají, jejich význam je uveden na stránce o názvosloví koordinačních sloučenin. Koordinační číslo 2 Toto číslo je známo pouze u komplexů Cu+, Ag+, Au+ a Hg2+, které mají plně zaplněné d-orbitaly. Struktura těchto komplexů je lineární. Typickým příkladem je kation diamminostříbrný [Ag(NH3)2]+, který je na obrázku.
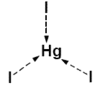
Koordinační číslo 3 Toto koordinační číslo je velmi vzácné. Je známé jen u některých komplexů s objemnými ligandy jako je například [Cu{SC(NH2)2}3]+. Z komplexů s jednoduššími ligandy je toto koordinační číslo známo pouze u trijodidortuťnatého kationtu [HgI3]- v kombinaci s vhodným kationtem (na obrázku). Tvar komplexu je rovnostranný trojúhelník. U některých komplexů je toto koordinační číslo pouze zdánlivé - například [CuCl3]- je ve skutečnosti polymerní koordinační číslo 4.
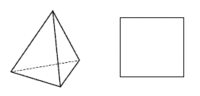
Koordinační číslo 4 Toto koordinační číslo je druhé nejběžnější a odpovídá mu tetraedrické a čtvercové uspořádání koordinační sféry. Výběr mezi oběma geometriemi závisí do určité míry na elektronové konfiguraci centrálního atomu. Jestliže jde o atom se sféricky symetrickou elektronovou konfigurací (elektrony jsou pravidelně uspořádány kolem jádra), pak se budou ligandy snažit uspořádat tak, aby byly co nejdále od sebe. Tomu odpovídá tetraedrické uspořádání. Tato situace nastává u komplexů s a p-prvků (např. [BF4]-) a u těch d-prvků, které buď dosáhly skupinového oxidačního čísla (všechny orbitaly prázdné, např. Mn+7 - MnO4-), nebo mají konfiguraci d5 příp. d10 (symetrické konfigurace, např. Fe+3, Cu+ - [Cu(py)4]+, Ni0 - [Ni(CO)4]). Centrální atomy s jinou konfigurací budou preferovat čtvercové uspořádání komplexů. Platí to především pro konfiguraci d8 (Pd+2, Pt+2), která ve většině případů vede ke čtvercovému uspořádání (výjimku tvoří Ni2+, který tvoří běžně také tetraedrické komplexy). Čtvercové uspořádání ovšem vyžaduje alespoň jeden volný d orbital pro hybridizaci dsp2. Jsou-li rozdíly v energii mezi čtvercovým a tetraedrickým uspořádáním malé (např. u některých komplexů Ni+2 nebo Cu+2), mohou existovat komplexy v obou geometriích nebo může mezi oběma docházet k vzájemné přeměně - (NH4)2[CuCl4] je čtvercový a Cs2[CuBr4] je přibližně tetraedrický. Čtverec a tetraedr jsou pak spíše extrémními možnostmi uspořádání ligandů a skutečný tvar leží někde mezi nimi. Tento jev se nazývá konformační izomerií a je o něm pojednáno níže.
Koordinační číslo 5 Koordinační číslo 5 bylo dříve považovalo za vzácné. Dnes jsou známy komplexy s tímto koordinačním číslem od všech centrálních atomů s konfigurací od d1 do d9. Tomuto koordinačnímu číslu odpovídají dvě mezní struktury – čtvercová pyramida ([VO(acac)3]) a trigonální bipyramida. Jelikož energie přeměny jedné limitní struktury v druhou je často malá, má většina komplexů strukturu odpovídající přechodu mezi oběma geometriemi. Mnohé sloučeniny s pětivazným centrálním atomem se chovají způsobem, který označujeme jako fluxionální. To znamená, že existují ve dvou nebo více chemicky ekvivalentních strukturách, které přecházejí jedna v druhou takovou rychlostí, že je nelze vzájemně rozlišit fyzikálním měřením. Určitou výjimkou u tohoto koordinačního čísla jsou komplexy (především Ni+2 a Co+2) s tzv. „ tripod“ ligandy, např. P(CH2CH2PR2)3, které si svou strukturou vynucují jednoznačně tvar trigonální bipyramidy.
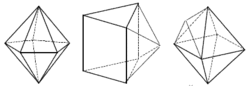
Koordinační číslo 6 Toto koordinační číslo je nejběžnější a odpovídá mu oktaedrické a trigonálně prizmatické uspořádání koordinační sféry. Komplexy jsou výhradně oktaedrické. Právě na těchto komplexech Alfred Werner obhajoval svou teorii o koordinačních sloučeninách. Podařilo se připravit pouze několik trigonálně prizmatických komplexů - např. [Re(S2C2Ph2)3]. V reálných komplexech je oktaedr vždy nějakým způsobem deformován. I pokud se jedná o komplex s homogenní koordinační sférou (např. šest stejných ligandů ), dochází k deformacím vlivem tzv. Jahn – Tellerova efektu. Ten je způsoben nerovnoměrným rozložením elektronů centrálního atomu. Existují v podstatě tři typy deformací pravidelného okatedru: protažení nebo stlačení ve směru dvou protilehlých vrcholů, protažení nebo stlačení ve směru dvou protilehlých stěn a vzájemná rotace dvou protilehlých stěn. Poslední deformace vede v krajním případě až k tvaru trigonální prizma.
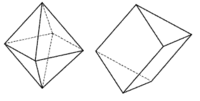
Koordinační číslo 7 Tomuto koordinačnímu číslu odpovídají tři základní prostorová uspořádání : pentagonální bipyramida ([ZrF7]3- a [HfF7]3-) a očepičkované trigonální prizma ([NbF7]2- a [TaF7]2-) a očepičkovaný oktaedru ([NbF6O]) (sedmý ligand je umístěn nad některou ze stěn trigonálního prizmatu a oktaedru). Podobně jako u všech dalších vyšších koordinačních čísel je rozdíl energií mezi těmito uspořádaními velmi malý a o konkrétním tvaru rozhodují především sterické požadavky ligandů.
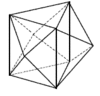
Koordinační číslo 8 Nejpravidelnějším uspořádáním pro koordinační číslo 8 je krychle, přesto se s tímto tvarem u komplexů prakticky nesetkáme. Díky vzájemnému odpuzování ligandů dochází k deformacím, které vedou na tvar dodekaedru ([ZrF8]4- a [Mo(CN)8]4- nebo čtvercového antiprizmatu ([TaF8]3- a [ReF8]2-) (krychle s horní stěnou pootočenou o 45°). Rozdíl energií mezi těmito uspořádaními je velmi malý a o konkrétním tvaru rozhodují především sterické požadavky ligandů.
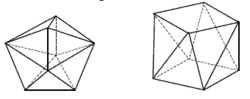
Koordinační číslo 9 Většina komplexů s tímto koordinačním číslem má tvar trojbokého hranolu, kde nad každou ze tří svislých stěn je umístěn další ligand (na obrázku) ([ReH9]2-) (jde v podstatě o trigonální prizma, které má nad každou ze svých stěn ještě jeden ligand). Existují i jiná uspořádání, ale mnohá z nich jsou velmi nepravidelná.
Koordinační čísla větší než 9 Tato koordinační čísla nejsou běžná a vyskytují se především u lehčích lanthanoidů a aktinoidů. Tedy u atomů s dostatečně velkým atomovým poloměrem. Navíc je nutné soudit, že k dosažení takto vysokých koordinačních čísel jsou nutné f-orbitaly. Pro koordinační číslo 10 existuje komplex [La(H2O)4edta], pro koordinační číslo 11 [La(dapbah)(NO3)3], pro koordinační číslo 12 [Ce(NO3)6]3-. Vyšší koordinační čísla již nejsou ani mezi lanthanoidy a aktinoidy častá, ale vyskytují až do koordinačního čísla 16.
Izomerie koordinačních sloučenin
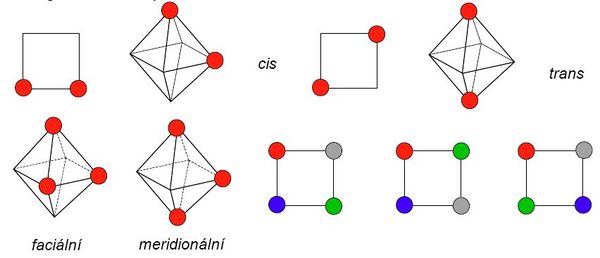
U komplexních sloučenin je izomerie velmi častým jevem. Jsou to sloučeniny se stejným chemickým složením, ale rozdílnou strukturou. Můžeme rozlišit několik základních typů tohoto jevu: Podrobnější informace naleznete v článku o Izomerii koordinačních sloučenin. Konformační izomerie přichází v úvahu pro každé koordinační číslo vyšší než 3 a jakoukoliv jemu odpovídající geometrii. Izomery se navzájem liší pouze svou stereochemií. Např. existuje [NiBr2(PEtPh2)2], který byl připraven jako zelený tetraedrický i jako žlutý čtvercový komplex. Konformační izomery musí mít srovnatelnou stabilitu a aby je bylo možné od sebe oddělit, musí existovat dostatečně vysoká energetická bariéra pro jejich vzájemnou přeměnu. Geometrická izomerie vzniká u komplexů, jejichž koordinační číslo je větší než 3. S geometrickou izomerií se nejčastěji setkáváme u čtvercových a oktaedrických komplexů. V těch mohou ligandy (resp. jejich donorové atomy) obsadit sousední (cis) nebo protilehlé vrcholy (trans). U oktaedrických komplexů typu [Ma3b3] mohou navíc existovat dvě geometrické formy lišící se polohou trojice donorových atomů. Ty mohou obsadit buď vrcholy jedné stěny oktaedru (faciální uspořádání), nebo tři polohy na „obvodu“ oktaedru (meridionální uspořádání). Čtvercové komplexy se čtyřmi různými ligandy pak mohou existovat ve třech geometricky izomerních formách.
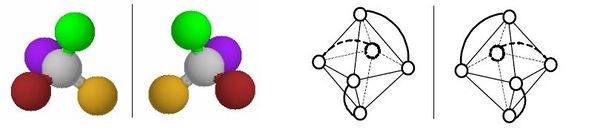
Optická izomerie vzniká u opticky aktivních látek. Optické izomery (tzv. enantiomery nebo antipody) můžeme očekávat u takových látek, v jejichž struktuře není žádný prvek symetrie kromě identity (nemají osu, rovinu ani střed symetrie). Takové látky, které nazýváme chirální nebo asymetrické, se mohou vyskytovat ve dvou formách, které se k sobě mají jako předmět a jeho obraz v zrcadle (nebo jako levá a pravá ruka). Takové dva izomery vypadají na první pohled zcela stejně, ovšem nelze je žádným otáčením a posunováním ztotožnit. Významnou vlastností chirálních látek je jejich schopnost otáčet rovinu polarizovaného světla– jsou tzv. opticky aktivní. Enantiomery mají téměř všechny fyzikální a chemické vlastnosti stejné. Liší se pouze tím, že otáčejí rovinu polarizovaného světla (světlo, jehož vlny „kmitají“ jen v jednom směru) každý na jinou stranu. Podle toho se označují jako levotočivé (dříve označované l nebo -) a pravotočivé (d nebo +). Obě formy se také mírně liší v indexu lomu a schopností absorbovat záření. Směs obou enantiomerů v molárním poměru 1 : 1 neotáčí rovinu polarizovaného světla a nazývá se racemická směs (racemát). Absolutní konfiguraci lze určit jedině kompletní rentgenostrukturní analýzou. Optické izomery existují u čtvercových, tetraedrických a oktaedrických komplexů. U čtvercových komplexů je optická izomerie vzácná a může nastat pouze v případě vhodně nesymetrických ligandů. U tetraedrických komplexů by bylo možné očekávat větší rozšíření optické izomerie, protože každý tetraedrický komplex se čtyřmi různými ligandy musí být opticky aktivní. Takovéto komplexy je však obtížné připravit a tak i v tomto případě byly připraveny opticky aktivní látky pouze s vhodnými bidentátními ligandy. Nejčastěji se ovšem optická aktivita projevuje u oktaedrických komplexů. V podstatě každý oktaedrický komplex typu [M(aa)3] nebo cis-[M(aa)2L2] (kde aa je bidentátní ligand) může existovat ve dvou zrcadlově převrácených formách. Pokud je ligand v takovém komplexu sám o sobě opticky aktivní (např. 1,2-propandiamin), pak se počet možných optických izomerů samozřejmě zvyšuje. Izomerům se v takovém případě říká diastereoizomery. Ty už se mohou lišit i jinými vlastnostmi, např. rozpustností, stabilitou,…
Ionizační izomerie vzniká, jestliže izomery poskytují v roztoku různé ionty. Příkladem dvojice ionizačních izomerů jsou [Pt(NH3)4Cl2]Br2 a [Pt(NH3)4Br2]Cl2 nebo [Co(NH3)5(SO4)]Br a [Co(NH3)5Br]SO4. Hydrátová izomerie vzniká při rozdílné přítomnosti vody vázané uvnitř a mimo koordinační sféru. Typickým příkladem je CrCl3.6H2O, který existuje ve třech formách: [Cr(H2O)6]Cl3 (fialový), [Cr(H2O)5Cl]Cl2.H2O (světle zelený) a [Cr(H2O)4Cl2]Cl.2 H2O (temně zelený). Vazebná izomerie vzniká, když se v komplexu váže ligand s větším počtem donorových atomů, které přitom nemůže použít současně (ambidentátní ligandy). Při tom může teoreticky nastat situace, že se váže v jinak stejných sloučeninách jiným donorovým atomem. Případy, kdy jsou takové izomery izolovatelné, jsou řídké a omezují se v podstatě na komplexy NO2- a SCN-. Příklady vazebných izomerů jsou dvojice [Co(en)2(NO2)2]+, [Co(en)2(ONO)2]+ a [Pd(PPh3)2(NCS)2], [Pd(PPh3)2(SCN)2]. Abychom odlišili způsob vazby ligandů, uvádí se koordinovaný donorový atom ve vzorci jako první. Odlišují je též od sebe odlišným názvem nebo vyznačením donorového atomu. NO2- nazývá se nitro, ONO- nitrito, NCS- N-thiokyanato a SCN- S-thiokyanato. Koordinační izomerie vzniká ve sloučeninách složených z komplexního kationtu i aniontu, který se může měnit rozdělením ligandů mezi oběma ionty, např. [Co(en)3][Cr(CN)6] a [Cr(en)3][Co(CN)6] nebo [PtII(NH3)4][PtIVCl6] a [PtIV(NH3)4Cl2][PtIICl4]. Izomery se v tomto případě liší fyzikálně-chemickými vlastnostmi. Polymerační izomerie není izomerií v pravém slova smyslu. Některé komplexy existují ve formách jednoduchých (monomerních) a také jako dimery nebo trimery. Takové látky mají stejný sumární vzorec, ale liší se molekulovou hmotností. Např. látka sumárního vzorce [Pt(NH3)2Cl2] existuje ve dvou monomerních formách (cis a trans), ale také jako dimer [Pt(NH3)4][PtCl4] a trimer [Pt(NH3)3Cl]2[PtCl4].
Barevnost komplexů
Látka je obecně barevná, pokud je schopna své vnitřní energetické přechody, vyžadující jisté množství energie, dodáné v podobě kvanta viditelného světla, vyzářit v podobě viditelného světla. Energie světelného kvanta E je dána rovnicí :
- E = hν
kde h je Planckova konstanta a ν frekvence. Pokud je látka schopna absorbovat určitou oblast vlnových délek viditelného světla (určitou „barvu“), pak se na bílém světle jeví zbarvena tzv. doplňkovou (komplementární) barvou, v jejímž spektru absorbované vlnové délky chybí. Doplňková barva se určuje pomocí diagramu chromaticity (na obrázku), doplňková barva (námi viditelná) je naproti barvě absorbované. Barevné komplexní sloučeniny tedy musí absorbovat vlnové délky viditelného světla, tedy v rozsahu asi 380 – 770 nm. Energie tohoto záření ovšem nepostačuje na přechod elektronu do orbitalu s vyšším kvantovým číslem (např. 3d→ 4p), proto je nutné předpokládat méně energeticky náročné elektronové přechody. Ukázalo se (zjednodušeně řečeno), že takovými vhodnými přechody mohou být tzv. d-d přechody elektronů mezi různými energetickými hladinami rozštěpených d-orbitalů , které zavedla teorie krystalového pole. Existuje relativně jednoduchá souvislost mezi vlnovou délkou nebo energií absorbovaného záření a silou ligandového pole komplexů – tedy energetickým rozdílem mezi rozštěpenými d-orbitaly. Čím vyšší síla ligandového pole, tím vyšší energii vyžaduje přeskok elektronu a tím kratší vlnovou délku světla komplex absorbuje. Změna zbarvení komplexu vlivem různých ligandů je základem dříve zmíněné spektrochemické řady, kde jsou ligandy seřazeny v podstatě podle klesající vlnové délky světla absorbovaného příslušnými komplexy. Závěrem je třeba zmínit, že barva komplexu není dána pouze absorbováním záření při d-d přechodech elektronů centrálního atomu. Energii viditelného záření mohou odpovídat i přechody elektronů centrálního atomu do prázdných orbitalů ligandu nebo naopak (absorpční pásy přenosu náboje, tzv. CT-přechody „ charge transfer).
Stabilita komplexních sloučenin
Konstanta stability (komplexity)
Stabilitou komplexních sloučenin se rozumí jejich odolnost vůči rozpadu na volný centrální atom a ligandy. Lze ji také chápat jako snadnost vzniku komplexu z centrálního atomu ligandu (platí zcela obecně, že stabilnější sloučeniny snadněji vznikají). Stabilita komplexních sloučenin se nečastěji studuje a posuzuje v jejich vodných roztocích. V tomto případě ale při vzniku komplexu jde spíše o náhradu molekul vody komplexního aquaiontu za jiný ligand. Rozpad komplexu je naopak náhrada ligandu molekulou vody.
- [M(H2O)x]+xL↔[MLx]+xH2O
Tuto skutečnost je dobré mít na paměti i když se voda v běžném zápisu konstanty stability vypouští. Tato rovnice se v běžném zjednodušeném tvaru uvádí :
- M+xL↔MLx
Číselně lze celkovou stabilitu komplexu vyjádřit jako převrácenou hodnotu rovnovážné konstanty disociační reakce. Komplexy ve skutečnosti nedisociují najednou stejně jako najednou nevznikají. Mohou odštěpovat (nebo vázat) ligandy postupně po jednom a vzniklé „meziprodukty“ mohou být také stabilní. Pro jednotlivé stupně odštěpování ligandů lze samozřejmě také vyjádřit konstanty stability. Jako příklad výpočtu konstanty stability (viz obrázek) použijeme postupnou koordinaci chloridových aniontů na železitý kationt. Celková konstanta stability se poté spočítá jako součin jednotlivých dílčích (konsekutivních) konstant (hranaté závorky ve výrazu znamenají rovnovážné koncentrace).:
Pro jeden konkrétní komplex vždy platí, že konsekutivní konstanty stability postupně klesají s množstvím ligandů, tedy K1 > K2 >…> Kn Tento pokles je celkem snadno pochopitelný. Konsekutivní konstanty stability se týkají vždy odštěpení pouze jednoho ligandu z komplexu. Čím více ligandů bude vázáno na centrální atom (čím větší bude n), tím snadněji se jeden z nich může odštěpit. Vysvětlení lze podat i tak, že čím je více ligandů k odštěpení, tím roste pravděpodobnost, že se jeden z nich skutečně odštěpí a tím je tedy menší příslušná konsekutivní konstanta stability.
Faktory ovlivňující stabilitu komplexů
Hodnoty konstant stability komplexů jsou ovlivňovány řadou faktorů, které lze zhruba shrnout do tří následujících skupin.
- Vliv centrálního atomu na stabilitu komplexu nelze postihnout jednoduchým způsobem. Pro silně elektropozitivní prvky z 1. až 3. skupiny (včetně lanthanoidů) platí poměrně přesně, že stabilita komplexu roste s rostoucím nábojem a s klesajícím poloměrem centrálního atomu. To je způsobeno převažujícím iontovým charakterem interakce centrálního atomu s ligandy u těchto prvků. Pro komplexy přechodných kovů už tak jednoduchá závislost na oxidačním čísle a poloměru atomu neexistuje, protože se u nich mnohem výrazněji projevuje kovalentnost koordinační vazby a navíc se zde uplatňuje stabilizace elektronové konfigurace ligandovým polem (Stabilizační energie ligandového pole) Pro téměř všechny vysokospinové komplexy kovů v oxidačním stavu +2 platí pořadí stability komplexů dané tzv. Irwingovou – Williamsovou řadou: Mn < Fe < Co < Ni < Cu > Zn Pořadí stability nízkospinových komplexů se od této řady významně liší. Např. stabilita kyanokomplexů M2+ sleduje řadu V < Cr > Mn < Fe > Co > Ni > Zn Jak je možné snadno ověřit, odpovídá tato řada velmi dobře stabilizačním energiím ligandového pole (nezapadá pouze Mn).
- Vliv ligandu nejvýrazněji ovlivňující stabilitu komplexu je jeho dentacita (vaznost). Ligandy se dvěma nebo více donorovými atomy, které mohou s centrálním atomem uzavřít cyklická uspořádání, vykazují tzv. chelátový efekt, tj. významné zvýšení stability komplexů ve srovnání s monodentátními ligandy. Mezi nejstálejší komplexy patří cheláty s pěti a šestičlennými kruhy, v nichž úhly nejlépe odpovídají vazebným úhlům. Přitom bylo prokázáno, že pětičetné kruhy jsou stálejší v případě jednoduchých vazeb v kruhu, šestičlenné jsou výhodnější v přítomnosti dvojných vazeb. Menší kruhy pak již obvykle nejsou příliš stabilní díky vysokému pnutí. Z hlediska ligandu je pro stabilitu komplexu velmi významná bazicita ligandu.
- Vliv kombinace centrálního atomu a ligandu vysvětluje skutečnosti, že některé centrální atomy preferují určitý typ ligandu pro tvorbu stabilních komplexů. Byla tak zavedena koncepce tvrdých a měkkých Lewisových kyselin (centrálních atomů) a Lewisových bazí (ligandů). Za tvrdé kyseliny se považují kovy z prvních tří skupin periodické soustavy, z ostatních kovů především hliník. Jsou to kovy velmi elektropozitivní, s relativně malým iontovým poloměrem, u kterých existují tendence k tvorbě převážně iontových vazeb. Měkkými kyselinami jsou naopak především těžké d-prvky z druhé a třetí periody v nízkém oxidačním stavu, tedy prvky poměrně dost zaplněnými d-orbitaly, které budou jevit ochotu svůj relativní přebytek elektronů sdílet ve spíše kovalentní vazbě. Tvrdé báze jsou především ty ligandy, které mají relativně malé, ale silně elektronegativní donorové atomy (O, N, F). Z běžných ligandů jsou to amoniak, alifatické aminy, voda, hydroxidový anion, ethery, anionty kyslíkatých kyselin a fluoridy. Měkkými bázemi pak jsou především ligandy s těžšími donorovými atomy (S, P, As), π-donorové ligandy (acetylen, benzen), kyanidy, CO a těžší halogenidy.
Související články
- Koordinační chemie
- Ligand
- Centrální atom
- Koordinační vazba
- Koordinační číslo
- Izomerie koordinačních sloučenin
- Barevnost komplexů
- Stabilita komplexních sloučenin
- Magnetické vlastnosti koordinačních sloučenin
Literatura
- Dr. Heinrich Remy, Anorganická chemie 2. díl, 1. vydání 1961
- N. N. Greenwood - A. Earnshaw, Chemie prvků 2. díl, 1. vydání 1993 ISBN 80-85427-38-9
- Jursík F.: Anorganická chemie kovů. 1. vyd. 2002. ISBN 80-7080-504-8 (elektronická verze)
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |