Multimediaexpo.cz je již 18 let na českém internetu !!
V tiskové zprávě k 18. narozeninám brzy najdete nové a zásadní informace.
Elektrolýza
Z Multimediaexpo.cz
m (1 revizi) |
m (Nahrazení textu „<math>“ textem „<big>\(“) |
||
| Řádka 14: | Řádka 14: | ||
=== 1. Faradayův zákon === | === 1. Faradayův zákon === | ||
[[Hmotnost]] látky vyloučené na elektrodě závisí přímo úměrně na elektrickém proudu, procházejícím elektrolytem, a na [[čas]]e, po který elektrický proud procházel. | [[Hmotnost]] látky vyloučené na elektrodě závisí přímo úměrně na elektrickém proudu, procházejícím elektrolytem, a na [[čas]]e, po který elektrický proud procházel. | ||
| - | : < | + | : <big>\(m = A . I . t</math>, |
kde ''m'' je hmotnost vyloučené látky, ''A'' je [[elektrochemický ekvivalent]] látky, ''I'' je elektrický proud, ''t'' je čas | kde ''m'' je hmotnost vyloučené látky, ''A'' je [[elektrochemický ekvivalent]] látky, ''I'' je elektrický proud, ''t'' je čas | ||
nebo též | nebo též | ||
| - | : < | + | : <big>\(m = A . Q </math>, |
kde ''Q'' je [[elektrický náboj]] prošlý elektrolytem. | kde ''Q'' je [[elektrický náboj]] prošlý elektrolytem. | ||
=== 2. Faradayův zákon === | === 2. Faradayův zákon === | ||
[[Látkové množství|Látková množství]] vyloučená ''stejným'' nábojem jsou pro všechny látky ''chemicky ekvivalentní'', neboli elektrochemický ekvivalent ''A'' závisí přímo úměrně na [[molární hmotnost]]i látky. | [[Látkové množství|Látková množství]] vyloučená ''stejným'' nábojem jsou pro všechny látky ''chemicky ekvivalentní'', neboli elektrochemický ekvivalent ''A'' závisí přímo úměrně na [[molární hmotnost]]i látky. | ||
| - | : < | + | : <big>\(A = \frac {M_m}{F.z}</math>, |
kde ''F'' je [[Faradayova konstanta]] ''F'' = 9,6485×10<sup>4</sup> C.mol<sup>−1</sup> a ''z'' je počet elektronů, které jsou potřeba při vyloučení jedné molekuly (např. pro Cu<sup>2+</sup> → Cu je ''z'' = 2, pro Ag<sup>+</sup> → Ag je ''z'' = 1). | kde ''F'' je [[Faradayova konstanta]] ''F'' = 9,6485×10<sup>4</sup> C.mol<sup>−1</sup> a ''z'' je počet elektronů, které jsou potřeba při vyloučení jedné molekuly (např. pro Cu<sup>2+</sup> → Cu je ''z'' = 2, pro Ag<sup>+</sup> → Ag je ''z'' = 1). | ||
== Využití elektrolýzy == | == Využití elektrolýzy == | ||
Verze z 14. 8. 2022, 14:48
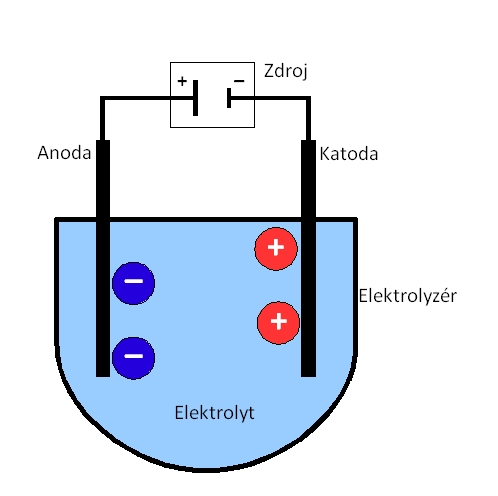
Elektrolýza je fyzikálně-chemický jev, způsobený průchodem elektrického proudu kapalinou, při kterém dochází k chemickým změnám na elektrodách.
Obsah |
Částicové vysvětlení
Elektricky vodivá kapalina obsahuje směs kationtů a aniontů vzniklých v kapalině disociací. Průchodem elektrického proudu dochází k pohybu kladných iontů k záporné elektrodě a záporných iontů ke kladné elektrodě. Na elektrodách pak může docházet k chemickým reakcím - mezi ionty a elektrodou, mezi ionty samotnými nebo mezi ionty a kapalinou (díky vyšší koncentraci iontů u elektrody).
Příklady elektrolýzy
Elektrolýza roztoku kuchyňské soli
Elektrolytem může být vodný roztok chloridu sodného NaCl (kuchyňská sůl), jenž je disociován na kladné ionty sodíku Na+ a záporné ionty chloru Cl−. Elektrody mohou být např. uhlíkové. Elektrické napětí mezi elektrodami usměrní pohyb Na+ k záporné elektrodě, ze které si iont H+ vezme elektron a změní se na elektricky neutrální částici - atom vodíku H, který se sloučí s jiným atomem vodíku za vzniku molekuly H2. Záporné ionty Cl− jsou přitahovány ke kladné elektrodě, které odevzdají svůj přebytečný elektron, a po dvou se sloučí do elektricky neutrální molekuly chloru Cl2. Na záporné elektrodě se z roztoku nevylučuje pevný sodík (to by se stalo, kdybychom místo vodného roztoku soli použili její taveninu - tímto procesem také lze s úspěchem kovový sodík vyrobit), ale probíhá zde redukce vodíku. Sodíkové kationty zůstávají v roztoku spolu s hydroxidovými anionty - jedná se o výrobu hydroxidu sodného.
Elektrolýza vody
Při elektrolýze vody se jako elektrolyt používá roztok kyseliny sírové H2SO4 a ve vodě elektrody z platiny, která s kyselinou sírovou nereaguje. Disociací molekul kyseliny sírové vznikají v roztoku kladné ionty vodíku H+ a záporné ionty SO42−. Kationty vodíku se pohybují k záporné elektrodě, od které přijímají elektron a slučují se do molekuly vodíku H2. Anionty SO42− se pohybují ke kladné elektrodě, které odevzdají své přebytečné elektrony a elektricky neutrální molekula SO4 okamžitě reaguje s vodou - vzniká nová molekula H2SO4. Při této reakci se uvolňují molekuly kyslíku O2. U záporné elektrody se tedy vylučuje z roztoku vodík, u kladné elektrody se vylučuje kyslík. Přitom v elektrolytu zůstává stejný počet molekul kyseliny sírové H2SO4, zatímco ubývá molekul vody H2O, koncentrace roztoku se zvyšuje. K elektrolýze vody se používá Hofmanův přístroj. Energetická účinnost elektrolýzy vody (získaná chemická energie/dodaná elektrická energie) dosahuje v praxi 60-70%.[1]
Galvanické poměďování
Elektrolytem při galvanickém poměďování může být roztok síranu měďnatého CuSO4 ve vodě, kladná elektroda musí být z mědi, zápornou elektrodu tvoří vodivý předmět, který má být pokovován. CuSO4 se ve vodě disociuje na kationty mědi Cu2+ a anionty SO42−. Ionty Cu2+ jsou přitahovány k záporné elektrodě, na které postupně vytváří měděný povlak. Ionty SO42− jsou přitahovány ke kladné měděné elektrodě, z které vytrhují kationty mědi Cu2+. Koncentrace roztoku zůstává stejná, měděná elektroda se časem rozpouští.
Faradayovy zákony elektrolýzy
1. Faradayův zákon
Hmotnost látky vyloučené na elektrodě závisí přímo úměrně na elektrickém proudu, procházejícím elektrolytem, a na čase, po který elektrický proud procházel.
- \(m = A . I . t</math>,
kde m je hmotnost vyloučené látky, A je elektrochemický ekvivalent látky, I je elektrický proud, t je čas nebo též
- \(m = A . Q </math>,
kde Q je elektrický náboj prošlý elektrolytem.
2. Faradayův zákon
Látková množství vyloučená stejným nábojem jsou pro všechny látky chemicky ekvivalentní, neboli elektrochemický ekvivalent A závisí přímo úměrně na molární hmotnosti látky.
- \(A = \frac {M_m}{F.z}</math>,
kde F je Faradayova konstanta F = 9,6485×104 C.mol−1 a z je počet elektronů, které jsou potřeba při vyloučení jedné molekuly (např. pro Cu2+ → Cu je z = 2, pro Ag+ → Ag je z = 1).
Využití elektrolýzy
- Výroba chlóru
- Rozklad různých chemických látek (elektrolýza vody)
- Elektrometalurgie - výroba čistých kovů (hliník)
- Elektrolytické čištění kovů - rafinace (měď, zinek, nikl)
- Galvanické pokovování (chromování, niklování, zlacení) - pokrývání předmětů vrstvou kovu
- Galvanoplastika - kovové obtisky předmětů, např. pro výrobu odlévacích forem
- Galvanické leptání - kovová elektroda se v některých místech pokryje nevodivou vrstvou, nepokrytá část se průchodem proudu elektrolytem vyleptá
- Polarografie - určování chemického složení látky pomocí změn elektrického proudu procházejícího roztokem zkoumané látky
- Akumulátory - nabíjení chemického zdroje elektrického napětí průchodem elektrického proudu
Schematický průběh elektrolýzy
Související články
Reference
- ↑ Bedřich Heřmanský, Ivan Štoll: Energie pro 21. století, ČVUT 1992
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |