Multimediaexpo.cz je již 18 let na českém internetu !!
Dusičnan stříbrný
Z Multimediaexpo.cz
(+ Typo) |
m (1 revizi) |
Aktuální verze z 4. 5. 2014, 10:19
| Dusičnan stříbrný | |
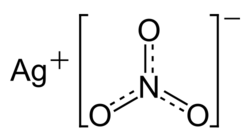
| |
| Chemický název | Dusičnan stříbrný |
| Sumární vzorec | AgNO3 |
| Molární hmotnost | 169.8731 g/mol |
| Registrační číslo CAS | 7761-88-8 |
| Teplota tání | 212 °C |
| Teplota varu | 444 °C rozkl. |
Dusičnan stříbrný je chemická sloučenina s chemickým vzorcem AgNO3. Tato stříbrná sůl kyseliny dusičné je fotosenzitivní přísadou fotografických filmů. Má korozivní vlastnosti. Rozpustné stříbrné soli jsou vysoce toxické pro bakterie a jiné nižší formy života. Důležité je využití v klasické fotografii, kde slouží dusičnan stříbrný k výrobě světlocitlivých sloučenin. Stříbrné ionty projevují velkou ochotu se nechat redukovat na kovové šedo-černé stříbro, proto pokud je dusičnanem stříbrným kontaminováno oblečení či kůže vznikají špatně odstranitelné skvrny.
Obsah |
Příprava
Dusičnan stříbrný lze připravit rozpuštěním kovového stříbra v kyselině dusičné za horka a následným odpařením roztoku. Reakce probíhá podle následující rovnice:
3Ag(s) + 4HNO3(aq) → 3AgNO3(aq) + 2H2O(l) + NO(g)
Aplikace
Fotografie
Při výrobě fotografického filmu dusičnan stříbrný reaguje s halogenidem sodným či draselným za tvorby nerozpustného halogenidu stříbrného in situ ve fotografické želatině, která je poté nanesena na pásy folie acetátu celulosy nebo polyesteru. Fotony ze slunečního světla, rentgenového záření či jiných zdrojů jsou schopny iniciovat chemickou řetězovou reakci, při níž foton, který zasáhne krystal halogenidu stříbrného uvolní elektrony z iontové mřížky. Tyto volné elektrony se pohybují krystalem a usídlí se ve strukturních poruchách. Ty pak přitahují kladné stříbrné kationy, jež jsou následně neutralizovány za tvorby shluků elementárního stříbra. Jedná se o takzvaný latentní obraz. Tento je pak možno pomocí vývojky přeměnit na obraz fotografický (U chloridů vzniká viditelný obraz i bez vývojky).
Výbušniny
Dusičnan stříbrný slouží jako výchozí sloučenina pro přípravu některých třaskavin jako jsou fulmináty, azidy či acetylidy stříbrné.
Elektrochemie
Dusičnan stříbrný lze použít jako zdroj stříbrných iontů při přípravě roztoků k pokovování.
Lékařství
Dusičnan stříbrný má antiseptické vlastnosti. Někde je dodnes jeho roztok kapán do očí novorozeňat k zamezení nakažení pohlavně přenosnými chorobami od infekční matky. Toto použití se však ukázalo jako nevhodné, protože může docházet ke vzniku toxické konjunktivitidy a navíc není dusičnan stříbrný v používané koncentraci dostatečně účinný proti chlamydiím a dalším mikrobům. Například jodovaný povidon je výrazně účinnější a současně je v očích lépe tolerován.[1]
Bývá také používán jako prostředek k chemickému vypalování lézí, bradavic, či k zastavování krvácení.[zdroj ?]
Biologie
V histologii a biochemii je dusičnan stříbrný používán jako prostředek k vybarvování stříbrem, sloužícímu k důkazu proteinů a nukleových kyselin .
Srážecí reakce
Pomocí dusičnanu stříbrného je možno zjistit přítomnost chloridových, bromidových či jodidových anionů.
Nejprve je nutné okyselit AgNO3 přidáním kyseliny dusičné, čímž dosáhneme odstranění rušivých iontů, jako jsou např. uhličitany nebo siřičitany. Tímto zamezíme vylučování siřičitanu či uhličitanu stříbrného a máme tak jistotu, že vyloučená sraženina je velkou pravděpodobností halogenid stříbrný.
2H+(aq)+SO32-→SO2(g)+H2O(l)
2H+(aq)+CO32-→CO2(g)+H2O(l)
Po přidání AgNO3(aq) ke vzorku roztoku halogenidu vzniká nerozpustná sraženina.
Její barva nám umožňuje identifikovat, jestli se jedná o chlorid, bromid či jodid.
Ag+(aq)+Cl-(aq)→AgCl(s) bílá
Ag+(aq)+Br-(aq)→AgBr(s) světle žlutá
Ag+(aq)+I-(aq)→Agl(s) žlutá
Pokud je AgCl nebo AgBr vystaven silnému světlu postupně zešedne v důsledku fotolýzy. (Vytváří elementární stříbro.)
Toxicita
Stejně jako většina stříbrných solí i dusičnan stříbrný je toxický. Již požití 2 gramů může být letální.[zdroj ?] Jako první pomoc se často podává vaječný bílek či mléko, neboť obsahují velké množství bílkovin. Bílkoviny jsou schopné svými volnými karboxylovými či thio skupinami vázat stříbrné ionty a zabránit tak otravě.
Reference
Externí odkazy
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |


