The final launch of the Allmultimedia.org will take place on February 24, 2026
(shortly after the 2026 Winter Olympics).
Jod
Z Multimediaexpo.cz
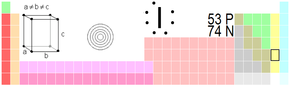
| Jód | |
| |
| Atomové číslo | 53 |
| Relativní atomová hmotnost | 126,90447(3) amu |
| Elektronová konfigurace | [Kr] 4d10 5s2 5p5 |
| Elektronegativita (Pauling) | 2,66 |
| Teplota tání | 113,7 °C (386,85 K) |
| Teplota varu | 184,3 °C (457,4 K) |
| Hustota | 4,933 g.cm-3 |
| Registrační číslo CAS | 7553-56-2 |
Je to důležitý biogenní prvek, jehož přítomnost v potravě je nezbytná pro správný vývoj organismu.
Obsah |
Základní fyzikálně–chemické vlastnosti
Jod je velmi vzácný prvek, který se v přírodě vyskytuje pouze ve sloučeninách. Byl objeven roku 1811 francouzským chemikem Barnardem Courtoisem. Pochybný je uváděný přírodní výskyt elementárního jodu z italských sopek jako minerálu.
Elementární jod je tmavě fialová až černá látka, která za atmosférického tlaku přechází přímo do plynné fáze, sublimuje. Její páry mají fialovou barvu a charakteristický dráždivý zápach. Ve vodě se rozpouští velmi slabě, lépe je rozpustný v ethanolu nebo nepolárních rozpouštědlech jako sirouhlík CS2, tetrachlormethan CCl4 nebo benzen C6H6.
Výskyt a výroba
Na Zemi je jód přítomen pouze ve formě sloučenin, většina z nich je rozpuštěna v mořské vodě. Je zde přítomen nejen jako jodid, ale také ve formě jodičnanu. Mineralogicky doprovázejí sloučeniny jodu analogické sloučeniny chloru a bromu, ovšem pouze ve velmi nízkých koncentracích.
Relativní zastoupení jodu v zemské kůře i ve vesmíru je velmi nízké. V zemské kůře je jod přítomen v koncentraci 0,1 až 0,5 ppm (mg/kg). V mořské vodě, kde se vyskytuje většina jodu přítomného na Zemi, dosahuje jeho koncentrace průměrné hodnoty 0,06 mg/l. Předpokládá se, že ve vesmíru na 1 atom jódu připadá 70 miliard atomů vodíku.
Základní surovinou pro výrobu jodu jsou mořské řasy, v jejichž pletivech se jod koncentruje. Oxidací jodidů, obsažených v popelu ze spálených řas, se získá elementární jod, který se rafinuje sublimací, tedy přeměnou látky z pevného do plynného skupenství.
Přírodní výskyt jodu jako minerálu je pochybný. Je uváděn bez dalších podrobnějších informací z Vesuvu a ostrova Vulcano (Liparské ostrovy) v Itálii.
Sloučeniny a využití
Roztok jodu ve směsi alkohol-voda je nazýván jodová tinktura a slouží v medicíně jako dezinfekční činidlo. Jod a jodid draselný se užívá k přípravě podobně účinkujícího Lugolova činidla. V poslední době se však jako antiseptikum obvykle používá šetrnější a stabilnější jodovaný povidon, což je komplex jodu a polyvinylpyrrolidonu.
Se škrobem stvoří intenzivně zbarvený modrý komplex, který v analytické chemii slouží jako důkaz jodu nebo polysacharidů. Tvorba zmíněného komplexu je využívána jako indikace bodu ekvivalence při jodometrických titracích, při nichž je základní reakcí oxidace thiosíranu sodného roztokem elementárního jódu.
Ve sloučeninách se jod vyskytuje v mocenství I-, I+, I3+, I5+ a I7+.
Praktický význam mají pouze některé jeho soli. Například nerozpustný jodid stříbrný, AgI, nachází využití ve fotografickém průmyslu.
S amoniakem tvoří jod velmi nestálou sloučeninu, jododusík, NI3, která se v suchém stavu explozivně rozkládá i při velmi slabém podnětu. Její praktické využití spadá spíše do oblasti chemických „žertů“.
Zdravotní významnost
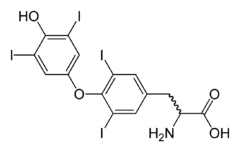
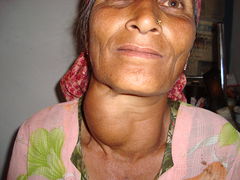
Jod patří mezi prvky, nezbytné pro vývoj lidského organizmu. Je součástí hormonů vylučovaných štítnou žlázou, z nichž nejdůležitější je thyroxin (viz strukturní vzorec). Skupina hormonů štítné žlázy ovlivňuje především vývoj pohybové soustavy a mozku v raných fázích vývoj, a proto může jejich nedostatek negativně ovlivnit inteligenci (kreténismus). Navenek se nedostatek jodu projevuje jako vole neboli struma.
Protože jod je přítomen především v mořské vodě, jsou mořské ryby a plody moře jeho dobrým zdrojem. Pro vegany a veganky jsou dobrými zdroji jodizovaná sůl (ačkoliv u té není snadné zjistit na jaké úrovni je jodizovaná) a minerální doplňky. Jod se také nachází v mořských řasách, ale tam je jeho množství velice proměnlivé. Jod je také ve zvýšené koncentraci přítomen v některých minerálních vodách. V současné době se uměle přidává do řady mléčných výrobků (jogurty, mléčné nápoje, mléčné krémy), které jsou pravidelně konzumovány dětmi. Obvykle se jedná o miligramová množství jodistanu sodného, která zajišťují pravidelný přísun potřebného množství jodu pro dospívající organizmus.
Důkaz jodu
Rozpusťte jod v ethanolu - tím vytvoříte tmavěoranžovou jodovou tinkturu. Tinkturu kápněte na škrob (stačí když použijete rozemletou bramboru). Škrob by se měl obarvit do modro-fialových odstínů.
Zajímavosti
Dnem jodu je 6. březen.
Literatura
- Cotton F.A., Wilkinson J.:Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973
- Holzbecher Z.:Analytická chemie, SNTL, Praha 1974
- Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- N. N. Greenwood - A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993 ISBN 80-85427-38-9
Externí odkazy
- Periodická soustava a tabulka vlastností prvků
- Chemický vzdělávací portál
- WebElements (anglicky)
- Periodická tabulka prvků
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |