Plastidová DNA
Z Multimediaexpo.cz
m (Nahrazení textu) |
m (1 revizi) |
Aktuální verze z 23. 9. 2013, 09:13
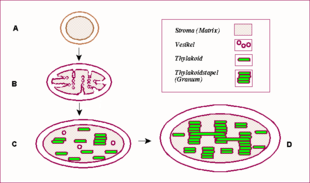
2. mezimembránový prostor
3. vnitřní membrána
4. stroma (vodný roztok)
5. lumen (dutina) thylakoidu
6. membrána thylakoidu
Plastidová DNA (pDNA, také plastom) je DNA, která se nalézá v plastidech. Plastidy jsou organely vyskytující se v některých eukaryotických buňkách, kde vykonávají různé specializované funkce. Protože plastidy mají vlastní nezávislou genetickou informaci obsaženou právě v plastidové DNA, označují se odborně jako semiautonomní organely buněk. Plastidová DNA je podobně jako mitochondriální DNA nositelkou mimojaderné dědičnosti. Existence plastidové DNA byla dokázána v roce 1962 Hansem Risem a Walterem Plautem, i když se předpokládala již dříve.[1]
Příkladem plastidů typických v rostlinných buňkách jsou chloroplasty, v nichž se odehrává fotosyntéza, která rostlině zajišťuje přeměnu světelné energie na chemickou. Plastidová DNA obsažená v chloroplastech se označuje jako chloroplastová DNA (cpDNA či ctDNA). Předpokládá se, že chloroplasty v rostlinách jsou původním a nejstarším druhem plastidů. Jejich DNA je odvozena od sinicového předka chloroplastů, který byl před stamilióny let v procesu evoluce eukaryotické buňky touto buňkou pohlcen.[2] Navíc například u krásnooček či skrytěnek existují plastidy vzniklé druhotným pohlcením eukaryotické buňky, která již obsahovala chloroplast, ale i tyto sekundární plastidy rovněž obsahují genom sinice. Výjimkou je však útvar zvaný nukleomorf, tedy zbytkový genom buňkou pohlceného eukaryonta.[3]
Chloroplastová DNA se při pohlavním rozmnožování přenáší buď ze samičích pohlavních buněk, nebo ze samčích, ale někdy i od obou pohlaví. V buňce bývá přítomno více kopií plastidové DNA, a ta je obvykle kruhová, tedy ve tvaru uzavřené smyčky. Velikost pDNA, měřená jako počet nukleových bází, je velice rozmanitá, přičemž redukované plastidové genomy se nacházejí zejména u druhů, jejichž plastidy ztratily fotosyntetickou funkci (např. parazitická řasa Helicosporidium či výtrusovci).
Obsah |
Úvodem
Plastidy jsou speciální organely, které jsou přítomné v některých eukaryotických buňkách, tedy v buňkách se složitější strukturou a jistou vnitřní hierarchií. Konkrétně se plastidy vyskytují u rostlin (Plantae), dále například u obrněnek (Dinophyta), skrytěnek (Cryptophyta), hnědých řas (Phaeophyceae) či krásnooček (Euglenophyta). Původní funkcí plastidů je fotosyntéza, ačkoliv u některých organizmů jsou známy i plastidy neschopné fotosyntetizovat. Plastidy jsou od zbytku buňky odděleny několika membránami a tvoří tak samostatný „kompartment“. To, že navíc obsahují vlastní genom – tedy plastidovou DNA – naznačuje, že plastidy jsou do určité míry nezávislou jednotkou (označujeme je jako semiautonomní organely). DNA, čili deoxyribonukleová kyselina, je totiž přítomna ve všech buněčných organizmech, kde slouží jako genetický materiál, v němž jsou zapsány ve formě genetického kódu návody na výrobu všech bílkovin v buňce. Skutečnost, že i plastidy mají vlastní genom, ačkoliv nejsou samostatné organizmy, je tedy zdánlivě paradoxní. Mnohé studie však prokázaly, že plastid je zřejmě potomkem sinic,[4][5] které se kdysi dostaly do eukaryotické buňky a zdomácněly v ní, a že genom plastidů má s genomem sinic mnoho společných rysů.
Výzkum a jeho historie

(zvětšení: 10 000×, rastrovací elektronový mikroskop)
Úvahy o existenci mimojaderné dědičnosti v plastidech se objevovaly již v padesátých letech 20. století, ale pokusy o izolaci DNA byly neúspěšné. Úspěšně byla vlákna plastidové DNA dokázána až v roce 1962 Hansem Risem a Walterem Plautem z University of Wisconsin v jejich studii Ultrastructure of DNA-containing areas in the chloroplast of Chlamydomonas, a to v chloroplastech jednobuněčné řasy rodu Chlamydomonas.[1] V této studii již byla zmíněna hypotéza, že chloroplasty mohou být potomky prokaryotických endosymbiontů.[6] O rok později následovaly v rychlém sledu zprávy o izolaci plastidové DNA z nejrůznějších rostlin.[1] Dalším úspěchem vědy byla sekvenace kompletního chloroplastového genomu. Poprvé se tak stalo u porostnice mnohotvárné (Marchantia polymorpha)[7] Dodnes pak bylo osekvenováno více než 150 plastomů (genomů v plastidech).[8]
Chloroplastová DNA má některé vlastnosti, které usnadňují její využití k různým molekulárně biologickým studiím. Tento genom je totiž poměrně malý, přítomný v mnoha kopiích a poměrně dobře prostudovaný. Navíc poměrně pomalu mutuje a má mnoho zvláštností, které činí jeho výzkum zajímavý například pro evoluční či molekulární biology.[9]
Sekvenace DNA z plastidů dnes pomáhá vědcům odhalovat například evoluci eukaryotických organizmů, zejména těch s plastidem. Na základě těchto sekvencí se například zjišťuje, kolik sekundárních endosymbióz proběhlo v evolučním stromu eukaryot, jak probíhá genový transfer z organely do jádra či jaké jsou vývojové vztahy mezi různými skupinami eukaryot.[10] Mnohé studie využívají drobných rozdílů mezi pDNA jednotlivých druhů téhož rodu za účelem zjištění přesných příbuzenských vztahů mezi těmito druhy.[11] Rovněž se s ním pracuje při zjišťování migrací jednotlivých druhů rostlin, například údaje o rekolonizaci Evropy dubem (Quercus) po skončení doby ledové pramení právě zejména z výzkumu jejich cpDNA. Srovnáváním sekvencí plastidové DNA evropských dubů je možné zjistit, jaké populace jsou vzájemně příbuzné a pochází tedy pravděpodobně z jednoho místa.[12]
Popis
S výjimkou nukleomorfu, který je odlišného původu než běžná plastidová DNA, má řetězec pDNA zřejmě tvar uzavřené smyčky a označuje se tedy tradičně jako kruhový, podobně jako u většiny prokaryotických organizmů.[2] Některé současnější studie však podtrhují skutečnost, že plastidová DNA je o poznání komplikovanější struktura, která svoji stavbu mění v čase a cirkulární typ se objevuje spíše vzácněji.[13][14] U kukuřice byly dokonce pozorovány lineární, složitě větvené chromozomy a zastoupení kruhových molekul činilo pouze 3–4 %.[15] Jisté je však to, že pDNA má u různých druhů rozmanitou velikost a různý je i počet genů, které kóduje.
Množství plastidové DNA přítomné v buňce samozřejmě v první řadě závisí na počtu plastidů v buňce, ale dále pak také na počtu samotných molekul DNA v jednom plastidu a za třetí na velikosti plastidové DNA. Řasa Chlamydomonas má jen jeden chloroplast, avšak ten obsahuje až 80 molekul DNA. Listy kukuřice obsahují v každé buňce 20–40 chloroplastů, každý chloroplast obsahuje ale 20–40 molekul DNA. U kukuřice tvoří plastidová DNA 15 % celkového genomu v buňce, u řasy Chlamydomonas jen 7 %.[16]
Velikost
Velikost plastidového genomu je však velice rozmanitá. Zatímco u zelené řasy Stigeoclonium helveticum dosahuje 223 902 párů bází a představuje největší dosud známý plastidový genom,[17] u některých organizmů, které druhotně ztratily schopnost fotosyntézy, mají plastidové genomy mnohem menší velikost.[18] Velmi malé plastomy (asi okolo 35–40 tisíc párů bází) mají například zelené řasy rodu Helicosporidium[19] nebo výtrusovci (Apicomplexa) druhů Eimeria tenella[20] či Plasmodium falciparum.[21] U vyšších rostlin má nejmenší genom rovněž parazitická rostlina, která se jmenuje Epifagus virginiana, a to něco málo přes 70 000 párů bází.[22]
Struktura a geny

Kruhový plastidový genom (zejména u rostlin) má poměrně stabilní strukturu, u níž se dají vysledovat některé zákonitosti. Například chloroplastová DNA tabáku (Nicotiana) a játrovky (Marchantiophyta) je téměř stejná.[2] Obvykle se na ní rozlišují dvě oblasti, jejichž sekvence jsou obsažené v cpDNa vždy jen jednou –tzv. large single copy (LSC) a small single copy (SSC). Mezi nimi se nachází dvě oblasti, které obsahují tutéž sekvenci, ale s obráceným pořadím komplementárních bází. Tato část se označuje jako inverted repeat (IR), vyskytuje se u téměř všech rostlin a kóduje například geny pro ribozomální RNA. I když jsou geny kódované v IR u různých druhů odlišné, v rámci jedné kruhové molekuly jsou vždy obě sekvence zmíněného regionu až na směr zcela shodné a není znám mechanismus, který to způsobuje.[23] Tento region zřejmě stabilizuje DNA před výraznějšími strukturními změnami. Inverted repeat přesto zcela chybí u zástupců čeledi bobovitých (Fabaceae) a u některých jehličnanů (borovice, douglaska).[24] Je zřejmé, že plastidová DNA v různých liniích fotosyntetizujících organizmů prochází značnými strukturními změnami a někdy se značně odlišuje od zmiňovaného modelu. U některých obrněnek (Dinoflagellata) je například plastom zřejmě rozdělen do množství drobných kruhových molekul o délce jen asi 2–3 tisíce párů bází. Každý kruh obsahuje obvykle jeden gen, někdy však dva nebo také vůbec žádný.[25]
Rovněž počet plně funkčních (přepisovaných a translatových) genů je velice rozmanitý. Řádově obsahuje jedna molekula pDNA několik desítek či stovek genů, chloroplasty vyšších rostlin obvykle kolem 120 genů.[2] Tyto geny kódují čtyři molekuly ribozomální RNA a 20 ribozomálních proteinů (podílející se na stavbě ribozomů v chloroplastech), asi 30 různých transferových RNA, dále několik podjednotek chloroplastové RNA polymerázy, několik součástí fotosystémů I a II a ATP syntázy účastnící se fotosyntézy v chloroplastech, několik enzymů elektronového transportního řetězce, jednu podjednotku enzymu RuBisCO a další proteiny, některé s neznámou funkcí.[2] Z tohoto přehledu je poměrně zřejmé, že chloroplast není soběstačný a všechny jeho ostatní součásti, namátkou například malé podjednotky enzymu RuBisCO,[26] jsou transportovány z vnějšku z cytoplazmy. K této situaciu přispěl proces horizontálního transferu DNA z pDNA do jaderné DNA (viz níže).
Na druhou stranu je známo, že plastidová DNA uvnitř některých svých genů obsahuje i nekódující oblasti, tzv. introny, které jsou typické pro eukaryota. Introny jsou z čerstvě vytvořené mRNA odstraňovány díky procesu splicingu.[2]
Přepis, replikace a proteosyntéza
Na transkripci plastidové DNA se podílí dvě RNA polymerázy. První, složená z více jednotek, je kódovaná z velké části (vyjma podjednotky sigma) geny přítomnými v pDNA. Proto se anglicky označuje tato polymeráza jako plastid-encoded RNA polymerase čili PEP. PEP je velice podobná RNA polymerázám bakterií, zejména sinic. Druhá RNA polymeráza v chloroplastu se skládá pouze z jedné podjednotky a je kódovaná geny v samotném buněčném jádře (tzv. nucleus-encoded RNA polymerase, NEP). U organizmů s plastidy, které již ztratily svou fotosyntetickou funkci (např. mnohé parazitické rostliny), dochází obvykle ke ztrátě genů pro RNA polymerázu.[27]
K translaci (syntéze proteinů) dochází na ribozomech prokaryotického typu přímo uvnitř v plastidech. Tyto ribozomy jsou velice podobné ribozomům bakterií svou stavbou i citlivostí k antibiotikům. Syntéza proteinů začíná v chloroplastech translací N-formyl methioninu, zatímco pro eukaryota je typický methionin.[2] Genová exprese, tzn. vlastně míra syntézy určitých proteinů, je kontrolována zejména mírou translace na ribozomech, a je poněkud komplikovanější než u prokaryot. Je tak umožněna koordinace syntézy proteinů v jádře a plastidu.[28]
K replikaci genomu v plastidech dochází obvykle zcela průběžně, nezávisle na fázi buněčného cyklu, v níž se eukaryotická buňka nachází. Některý řetězec se tak zřejmě v určitém období zreplikuje i několikrát, zatímco jiná kopie vůbec. Přesto k určité regulaci replikace dochází.[2] Ústřední roli v něm zřejmě hrají plastidové DNA polymerázy, označované v některých studiích jako Os-PolI-like (Os je zkratka pro rostlinu Oryza sativa, z níž byl enzym izolován). Tyto jsou kódované jaderným genomem a vykazující značnou podobnost s polymerázou I sinic.[29] Samotný průběh replikace je zřejmě poměrně odlišný od replikace jaderné DNA, už jen z důvodu, že pDNA je obvykle popisována jako kruhová. Replikace začíná v typickém případě na dvou místech vzdálených 7000 párů bází, tedy v každém vláknu na jednom místě. DNA polymerázy na obou vláknech tvoří charakteristické D-loops, které se k sobě přibližují, nakonec splývají, ale každá DNA polymeráza pokračuje svým směrem, čímž postupně vzniká kruhová molekula, z níž na jedné straně vyhřezává dceřiný půlkruhovitý řetězec.[30]
Evoluce
- Podrobnější informace naleznete na stránce: eukaryogeneze
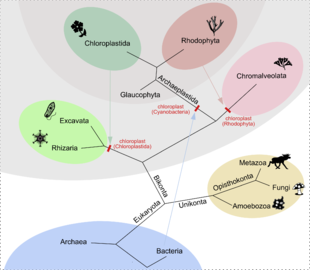
(představa o vzniku plastidů dle[31], aktualizace systému dle[32])
Plastidy a jejich DNA, která vykazuje nápadnou podobnost s DNA prokaryot, podobně jako mitochondriální DNA, jsou dokladem endosymbiotické teorie.[5] Na rozdíl od mitochondrií se plastidy vyvinuly u několika, často nepříbuzných skupin eukaryot.
Tzv. primární plastidy však pochází ze sinic a vznikly pravděpodobně pouze jednou, a to u rostlin, které v širším pojetí zahrnují nejen zelené rostliny (Viridiplantae), ale i ruduchy (Rhodophyta) a glaukofyty (Glaucophyta).[33] Plastidy u jiných druhů fotosyntetizujících eukaryot vznikly především sekundární endosymbiózou, tedy pohlcením jedné ze skupin rostlin. Pohlcením ruduchy vznikly plastidy (někdy kvůli svému původu zvané rhodoplasty) např. u různých heterokont (Heterokonta) a rozsivek (Bacillariophyceae), pohlcením zelené řasy vznikly plastidy u Chlorarachniophyta, některých krásnooček (Euglenozoa) a jedné obrněnky (Dinoflagellata).[5]
Dnešní pDNA kóduje jen asi 5–10 % původních genů svých sinicových předků. To je způsobeno buď ztrátou některých genů, které nebyly potřebné, nebo jejich přenosem do jádra.[10] V druhém případě se jedná o proces tzv. horizontálního přenosu genetické informace, díky němuž je množství genů prapůvodně pocházejících z plastidu (a ještě dříve z genomu sinic) dnes již začleněno do jaderné DNA.[2] Bylo zjištěno, že v jaderné DNA huseníčku rolního (Arabidopsis thaliana) je přítomno až 4 500 genů, které pochází ze sinic, z nichž vznikly plastidy. To tvoří 18 % z celkového počtu genů huseníčku. Dále se uvádí, že množství genů dnes přítomných v jaderné DNA této rostliny se u některých jiných skupin organizmů stále vyskytuje v jejich chloroplastové DNA.[10]
V souvislosti s horizontálním transferem je možno uvést, že neprobíhá jen výměna genomu mezi plastidem a jádrem, ale i mezi plastidem a mitochondrií. Přenos opačným směrem, tzn. z vnějšího prostředí do plastidu, je zřejmě jev vzácnější, ačkoliv i tento případ byl zaznamenán. V tom případě se obvykle do plastidové DNA začleňuje sekvence genů některých bakteriofágů (jev rovněž zvaný transdukce) nebo např. sekvence parazitické bakterie Agrobacterium tumefaciens.[34]
Dědičnost
- Podrobnější informace naleznete na stránce: mimojaderná dědičnost
Dědičnost pDNA při pohlavním rozmnožování souvisí se způsobem přenosu semiautonomních organel z pohlavních buněk do vznikající zygoty. Asi u dvou třetin vyšších rostlin se pDNA přenáší pouze ze samičích pohlavních buněk (maternálně, samčí chloroplasty z pylových zrn tedy nevstupují do zygoty). U zbytku vyšších rostlin je v zygotě přítomna kombinace samčích i samičích chloroplastů a dědičnost pDNA je tedy biparentální.[2] Dá se říci, že maternální dědičnost projevuje většina krytosemenných (ačkoliv některé jsou také biparentální). Zejména u některých nahosemenných však byla objevena výhradně paternální dědičnost, tzn. že všechna plastidová DNA v potomstvu pochází z pylového zrna. Mechanismy odstranění plastidů jednoho pohlaví jsou obvykle komplikovaná a mohou působit před nebo po oplození.[35]
Když určitá rostlina s biparentální dědičností plastidů zdědí od jednoho z rodičů defektní plastid (tzn. defekt způsobený urč. mutacemi v pDNA), je někdy možné pozorovat na listech mozaikovitou zeleno-bílou strukturu, neboť určité části pletiv jsou schopné fotosyntetizovat a jiné nikoliv. Tento jev je označován variegace.[2]
Literatura
- Cell and Molecular Biology of Plastids. Příprava vydání Bock, Ralph. Heidelberg : Springer, 2007. (Topics in Current Genetics; sv. 19.) ISBN 978-3-540-75375-9. S. 524.
- The Structure and Function of Plastids. Příprava vydání Wise, Robert R.; Hoober, J. Kenneth. Dordrecht : Springer, 2007. (Advances in Photosynthesis and Respiration.) ISBN 978-1-4020-6570-5. S. 575.
- PYKE, Kevin. Plastid Biology. 1. vyd. Cambridge : Cambridge University Press, 2009. ISBN 978-0521711975. S. 200.
Reference
- ↑ 1,0 1,1 1,2 25 years of chloroplast DNA. Plant Molecular Biology Reporter, 16. 03 1988, roč. 6, čís. 1, s. 41-46. Dostupné online. DOI:10.1007/BF02675310. (anglicky)
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 2,10 Alberts, Bruce , et al.. The Molecular Biology of the Cell. [s.l.] : Garland Science, 2002. (4th. ed.) Dostupné online. ISBN 0-8153-3218-1.
- ↑
- ↑ DOUGLAS, Susan E, Seán Turner Molecular evidence for the origin of plastids from a cyanobacterium-like ancestor. Journal of Molecular Evolution, 1991, roč. 33, čís. 3, s. 267-273. Dostupné online. DOI:10.1007/BF02100678. (anglicky)
- ↑ 5,0 5,1 5,2 ČEPIČKA, Ivan; KOLÁŘ, Filip; SYNEK, Petr. Mutualismus, vzájemně prospěšná symbióza; Přípravný text – biologická olympiáda 2007–2008. Praha : NIDM ČR, 2007. S. 87.
- ↑ RIS, H.; PLAUT, W.. Ultrastructure of DNA-containing areas in the chloroplast of Chlamydomonas. The Journal of Cell Biology, 06 1962, roč. 13, s. 383-391. Dostupné online. ISSN 0021-9525. (anglicky)
- ↑ Chloroplast Genome Structure; Structural Genomics, PS480 [online]. The Barley Information Server at Montana State University. Dostupné online. (anglicky)
- ↑ Eukaryotae Organelles Taxonomy / List [online]. NCBI. Dostupné online. (anglicky)
- ↑ CLEGG, M. T., B. S. Gaut, G. H. Learn, B. R. Morton Rates and patterns of chloroplast DNA evolution. Proceedings of the National Academy of Sciences of the United States of America, 19. 07 1994, roč. 91, čís. 15, s. 6795-6801. Dostupné online. ISSN 0027-8424. (anglicky)
- ↑ 10,0 10,1 10,2 MARTIN, William, Tamas Rujan, Erik Richly, Andrea Hansen, Sabine Cornelsen, Thomas Lins, Dario Leister, Bettina Stoebe, Masami Hasegawa, David Penny Evolutionary analysis of Arabidopsis, cyanobacterial, and chloroplast genomes reveals plastid phylogeny and thousands of cyanobacterial genes in the nucleus. Proceedings of the National Academy of Sciences of the United States of America, 2002, roč. 99, čís. 19, s. 12246-12251. Dostupné online. DOI:10.1073/pnas.182432999.
- ↑ BUTTERWORTH, Charles A., Robert S. Wallace Phylogenetic studies of Mammillaria (Cactaceae)--insights from chloroplast sequence variation and hypothesis testing using the parametric bootstrap. Am. J. Bot., 2004-07-01, roč. 91, čís. 7, s. 1086-1098. Dostupné online. DOI:10.3732/ajb.91.7.1086.
- ↑ PETIT, R. J., E. Pineau, B. Demesure, R. Bacilieri, A. Ducousso, A. Kremer Chloroplast DNA footprints of postglacial recolonization by oaks. Proceedings of the National Academy of Sciences of the United States of America, 02. 09 1997, roč. 94, čís. 18, s. 9996-10001. Dostupné online. ISSN 0027-8424. (anglicky)
- ↑ BENDICH, Arnold J.. Circular chloroplast chromosomes: the grand illusion. The Plant Cell, 2004-07, roč. 16, čís. 7, s. 1661-6. Dostupné online. ISSN 1040-4651. DOI:10.1105/tpc.160771.
- ↑ BOISSELIER-DUBAYLE, M. C., Jubier M. F.; Lejeune, B.; Bischler, H. Genetic Variability in the Three Subspecies of Marchantia polymorpha (Hepaticae): Isozymes, RFLP and RAPD Markers. Taxon, 1995-08, roč. 44, čís. 3, s. 363-376. Dostupné online. ISSN 00400262. DOI:10.2307/1223406.
- ↑ OLDENBURG, Delene J, Arnold J Bendich Most chloroplast DNA of maize seedlings in linear molecules with defined ends and branched forms. Journal of Molecular Biology, 2004-01-23, roč. 335, čís. 4, s. 953-70. Dostupné online. ISSN 0022-2836.
- ↑ Alberts, Bruce et al.. The Molecular Biology of the Cell; Table 14-2. Relative Amounts of Organelle DNA in Some Cells and Tissues. [s.l.] : Garland Science, 2002. (4th. ed.) Dostupné online. ISBN 0-8153-3218-1.
- ↑ Bélanger A.S., Brouard J.S., Charlebois P., Otis C., Lemieux C., Turmel M.. Distinctive architecture of the chloroplast genome in the chlorophycean green alga Stigeoclonium helveticum. Mol. Genet. Genomics, roč. 276, čís. 5. Dostupné online. DOI:10.1007/s00438-006-0156-2. PMID 16944205.
- ↑ KRAUSE, Kirsten. From chloroplasts to "cryptic" plastids: evolution of plastid genomes in parasitic plants. Current Genetics, 2008-09, roč. 54, čís. 3, s. 111-21. Dostupné online. ISSN 0172-8083. DOI:10.1007/s00294-008-0208-8.
- ↑ de Koning AP, Keeling PJ. The complete plastid genome sequence of the parasitic green alga Helicosporidium sp. is highly reduced and structured. BMC Biol., roč. 4. Dostupné online. DOI:10.1186/1741-7007-4-12. PMID 16630350.
- ↑ Cai, X., Fuller A.L., McDougald L.R., Zhu G. Apicoplast genome of the coccidian Eimeria tenella. Gene, roč. 321.
- ↑ CHAUBEY, Sushma, Ambrish Kumar, Divya Singh, Saman Habib The apicoplast of Plasmodium falciparum is translationally active. Molecular Microbiology, 2005-04, roč. 56, čís. 1, s. 81-9. Dostupné online. ISSN 0950-382X. DOI:10.1111/j.1365-2958.2005.04538.x.
- ↑ WOLFE, K. H., Morden, C.W; Palmer, J.D. Function and evolution of a minimal plastid genome from a nonphotosynthetic parasitic plant. Proceedings of the National Academy of Sciences of the United States of America, 1992-11-15, roč. 89, čís. 22, s. 10648-52. Dostupné online. ISSN 0027-8424.
- ↑ An introduction to genetic analysis. New York : Freeman, 2000. Dostupné online. Kapitola Structure of organelle chromosomes. (anglicky)
- ↑ STRAUSS, S. H., Palmer, J.D.; Howe, G.T.; Doerksen, A.H. Chloroplast genomes of two conifers lack a large inverted repeat and are extensively rearranged.. Proceedings of the National Academy of Sciences of the United States of America, 1988-06, roč. 85, čís. 11, s. 3898–3902. Dostupné online.
- ↑ HOWE, Christopher J., Adrian C. Barbrook, V. Lila Koumandou, R. Ellen R. Nisbet, Hamish A. Symington, Tom F. Wightman Evolution of the chloroplast genome. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, 2003-01-29, roč. 358, čís. 1429, s. 99-106; discussion 106-7. Dostupné online. ISSN 0962-8436. DOI:10.1098/rstb.2002.1176.
- ↑ STRZAŁKA, Kazimierz, Maria Kwiatkowska Transport of proteins from cytoplasm into plastids in chloramphenicol-treated bean leaf discs [online]. . S. 393-398. Dostupné online. DOI:10.1007/BF00380850
- ↑ LYSENKO, E., Kuznetsov, V. Plastid RNA Polymerases. Molecular Biology, roč. 39, čís. 5, s. 661-674. Dostupné online. DOI:10.1007/s11008-005-0081-1.
- ↑ MANUELL, Andrea L, Joel Quispe, Stephen P Mayfield Structure of the chloroplast ribosome: novel domains for translation regulation. PLoS Biology, 2007-08, roč. 5, čís. 8, s. e209. Dostupné online. ISSN 1545-7885. DOI:10.1371/journal.pbio.0050209.
- ↑ MORI, Yoko, Seisuke Kimura, Ai Saotome, Nobuyuki Kasai, Norihiro Sakaguchi, Yukinobu Uchiyama, Toyotaka Ishibashi, Taichi Yamamoto, Hiroyuki Chiku, Kengo Sakaguchi Plastid DNA polymerases from higher plants, Arabidopsis thaliana. Biochemical and Biophysical Research Communications, 2005-08-19, roč. 334, čís. 1, s. 43-50. Dostupné online. ISSN 0006-291X. DOI:10.1016/j.bbrc.2005.06.052.
- ↑ HEINHORST, S., Cannon, G.C. DNA replication in chloroplasts. J Cell Sci, 1993-01-01, roč. 104, čís. 1, s. 1-9. Dostupné online.
- ↑ Cavalier-Smith, Thomas. Only six kingdoms of life. Proceedings. Biological Sciences / The Royal Society, 2004, roč. 271, čís. 1545, s. 1251-62. Dostupné online. ISSN 0962-8452. DOI:15306349. (anglicky)
- ↑ Adl, Sina M., et al. The New Higher Level Classification of Eukaryotes with Emphasis on the Taxonomy of Protists. Journal of Eukaryotic Microbiology, 2005, roč. 52, čís. 5, s. 399-451. Dostupné online. (anglicky)
- ↑ Hedges S. B., Blair J. E., Venturi M. L., Shoe J. L. A molecular timescale of eukaryote evolution and the rise of complex multicellular life.. BMC Evol Biol, Jan 2004, čís. 28;4:2.. Dostupné online. PMID 15005799. (anglicky)
- ↑ CERUTTI, Heriberto, André Jagendorf Movement of DNA across the chloroplast envelope: Implications for the transfer of promiscuous DNA. Photosynthesis Research, 1995-11-01, roč. 46, čís. 1, s. 329-337. Dostupné online. DOI:10.1007/BF00020448.
- ↑ WHATLEY, Jean M.. ULTRASTRUCTURE OF PLASTID INHERITANCE: GREEN ALGAE TO ANGIOSPERMS. Biological Reviews, 1982, roč. 57, čís. 4, s. 527-569. Dostupné online. DOI:10.1111/j.1469-185X.1982.tb00373.x.
Externí odkazy
- (anglicky) Plastid Genome Evolution and Flowering Plant Phylogenetics – článek o genomu plastidů
- (anglicky) Chloroplast Genome Structure – starší text (syllabus přednášky) o plastidovém genomu
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |