Multimediaexpo.cz je již 18 let na českém internetu !!
Oxid sírový
Z Multimediaexpo.cz
Oxid sírový SO3 je jedním z oxidů síry. Je hlavní příčinou vzniku kyselých dešťů. Vyrábí se ve velkém množství jako prekurzor kyseliny sírové.
Obsah |
Příprava
Průmyslově se připravuje oxidací oxidu siřičitého
- 2 SO2 + O2 → 2 SO3.
Tato reakce je silně exotermická a je vratná; proto je nutno ji provádět za relativně nízkých teplot do 500 °C a za přítomnosti katalyzátorů (např. platiny, nebo oxidu vanadičného, wolframového, molybdenového aj.). Za vysokých teplot vyšších než 800 °C probíhá tato reakce opačným směrem a z oxidu sírového vzniká opět oxid siřičitý a kyslík]. V laboratoři se oxid sírový připravuje obvykle tepelným rozkladem síranu železitého
- Fe2(SO4)3 → Fe2O3 + 3 SO3
nebo destilací olea, což je roztok oxidu sírového v kyselině sírové.
Vlastnosti
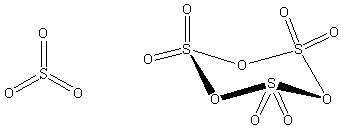
Struktura
V plynném stavu má monomerní forma oxidu planární uspořádání (grupa symetrie D3h). V kapalném i plynném skupenství existuje rovnováha mezi monomerem a trimerem (S3O9). V pevném stavu je oxid sírový vždy trimerní nebo polymerní. Cyklický trimer zaujímá vaničkovou konformaci (grupa symetrie D3v) podobnou cyklohexanu. Krystaluje v podobě bezbarvých rombických krystalů jako modifikace γ–SO3; pokud přijde do styku s vodou, tak vytváří bílé jehličkovité krystaly modifikace β–SO3, které jsou tvořeny směsí vláknitých polysírových kyselin. Nejstálejší formou oxidu sírového je α-SO3, který má složitou vrstevnatou strukturu, vzniklou příčným spojováním řetězců.
Chemické vlastnosti
S vodou reaguje velmi prudce, a podle stechiometrického poměru reakčních složek vzniká buď kyselina sírová
- SO3 + H2O → H2SO4
nebo oleum, případně směsi polysírových kyselin. Oxid sírový je velmi silné dehydratační činidlo: z organických látek odštěpuje vodu, např. jeho působením na ethanol vzniká ethen (ethylen)
- CH3CH2OH + SO3 → CH2=CH2 + H2SO4.
Reakci s halogenovodíky vznikají halogensírové kyseliny HSO3X, např. reakcí s chlorovodíkem
- SO3 + HCl → HSO3Cl
vzniká kyselina chlorsírová. Oxid sírový velmi silnou Lewisovou kyselinou. Tvoří proto velké množství různých aduktů s mnoha organickými i anorganickými ligandy.
Použití
Průmyslově vyráběný oxid sírový se ihned zpracovává na kyselinu sírovou.
Bezpečnost
Oxid sírový je silně žíravý, neboť ve styku s tkáněmi těla z nich odnímá vodu a mění se na kyselinu sírovou.
|
| Oxidy s prvkem v oxidačním čísle VI. |
|---|
|
Oxid molybdenový (MoO3) • Oxid rheniový (ReO3) • Oxid selenový (SeO3) • Oxid sírový (SO3) • Oxid tellurový (TeO3) • Oxid wolframový (WO3) • Oxid uhlíkový (CO3) • Oxid uranový (UO3) • Oxid xenonový (XeO3) |
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |