Foreground plně podporuje – RWD, HTML 5.0, Super Galerii a YouTube 2.0 !
Selen
Z Multimediaexpo.cz
| Selen | |
| |

| |
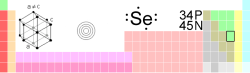
| Atomové číslo | 34 |
| Relativní atomová hmotnost | 78,96 amu |
| Elektronová konfigurace | [Ar] 3d10 4s2 4p4 |
| Skupenství | Pevné |
| Teplota tání | 221 °C (494 K) |
| Teplota varu | 685 °C (958 K) |
| Elektronegativita (Pauling) | 2,55 |
| Hustota | 4,81 g/cm3 (šedý) |
| Hustota | 4,39 g/cm3 (alfa) |
Selen, chemická značka Se, (latinsky: Selenium) je nekovový prvek za skupiny chalkogenů, významný svými fotoelektrickými vlastnostmi.
Obsah |
Základní fyzikálně-chemické vlastnosti
Selen je poměrně vzácný prvek, byl objeven roku 1817 Jönsem Jacobem Berzeliem. Elementární selen se vyskytuje v několika krystalických formách, jejichž barva je buď šedá nebo tmavě červená. Je prakticky nerozpustný ve vodě, poměrně dobře se rozpouští v sirouhlíku. V přírodě se vyskytuje nejméně v šesti alotropických modifikacích, ve třech červených moniklinických (jednoklonných) formách, v krystalické šedé, hexagonální (šesterečné) formě pak jako černý sklovitý selen.
Výskyt, výroba
Selen obvykle doprovází síru a tellur v jejich rudách. Je proto také obvykle získáván z odpadů po spalování síry při výrobě kyseliny sírové nebo ze zbytků po elektrolytické výrobě mědi ze sulfidických rud.
Relativní zastoupení selenu v zemské kůře i ve vesmíru je velmi nízké. V zemské kůře je selen přítomen v koncentraci 0,05–0,09 ppm (mg/kg). V mořské vodě je jeho koncentrace na hranici měřitelnosti analytickými technikami, obvykle je uváděna hodnota 0,09 mikrogramů/l. Předpokládá se, že ve vesmíru na 1 atom selenu připadá půl miliardy atomů vodíku. Elementární selen je za normálních podmínek stálý, poměrně snadno se slučuje s kyslíkem a halogeny. Ve sloučeninách se selen vyskytuje v mocenství Se2–, Se2+, Se4+ a Se6+. Výskyt jako minerál viz článek selen (minerál).
Sloučeniny a využití
Oxidy selenu vytváří reakcí s vodou příslušné kyseliny a existují i jejich soli s elektropozitivními prvky, nejstálejší z nich jsou selenany, seleničitany alkalických kovů. Technologický význam selenu spočívá v současné době ve výrobě fotočlánků. Jedná se o zařízení, která za využití fotoelektrického jevu po ozáření světlem přímo produkují elektrickou energii. Selenidy mědi, galia a india jsou v tomto směru velmi perspektivními sloučeninami a dnes fungují fotoelektrické články na bázi selenu jako zdroje elektrické energie především v kosmickém výzkumu pro napájení přístrojů na oběžné dráze pomocí tzv. solárních panelů. Fotočlánky s obsahem selenu se však používají i pro měření intenzity dopadajícího světla jako expozimetry, např. ve fotoaparátech a kamerách. Také většina kopírovacích a reprodukčních přístrojů je osazena selenovými fotočlánky. Selen se také dříve používal v laserových tiskárnách na výrobu světlocitlivého válce, který možňuje samotný tisk. Z důvodu jeho vlivu na životní prostředí již cca od roku 1992 počala být pro světlocitlivý povrch používána organická fotocitlivá fólie. (OPC - Organic Photo Conductor) Při tisku se opotřebovává otěrem, obvykle se udává jeho životnost počtem výtisků.

Selen ve výživě
Přestože většina sloučenin selenu je značně toxická, je zvláště v posledních letech intenzivně zkoumán vliv nedostatku selenu v každodenním potravinovém příjmu.
Bylo zjištěno, že pravidelný snížený příjem selenu v potravě nepříznivě ovlivňuje především kardiovaskulární systém a zvyšuje riziko infarktu myokardu a cévních onemocnění. Nedostatek selenu v potravě těhotných žen může nepříznivě působit na vývoj plodu. Selen funguje v organizmu jako antioxidant, který likviduje volné radikály, a tím snižuje riziko vzniku rakovinného bujení.
Důležité přitom je i to, aby celková denní dávka selenu nepřekročila jistou hranici. Za optimální dávku se v současné době pokládá kolem 60–200 mikrogramů selenu denně. Naopak dávky nad 900 mikrogramů denně jsou již toxické, způsobují poruchy trávení, vypadávání vlasů, změny nehtů a deprese.
Selen je v potravě nejvíce obsažen v ořeších, vnitřnostech a mořských rybách. V současné době je na trhu řada potravinových doplňků, které obsahují optimální denní dávku selenu. Při jejich užívání se však nutno postupovat opatrně, protože pravidelné předávkování selenem (ale i jinými stopovými prvky) může působit negativně.
Byly činěny i pokusy o umělé zvyšování obsahu selenu v obilninách, které dále sloužily k přípravě pečiva (např. ve Finsku). Celkově se však tato praxe neujala, protože je jen obtížně kontrolovatelné, jaké množství takto dopovaných potravin jednotliví obyvatelé reálně přijímají a může docházet i k nechtěnému předávkování.
V roce 2009 v našem Výzkumném ústavu bramborářském v Havlíčkově Brodě skončil pětiletý projekt, zabývající se zvýšením obsahu selenu v bramborách.[1]
Literatura
- Cotton F. A., Wilkinson J.: Anorganická chemie, souborné zpracování pro pokročilé, Academia, Praha 1973
- Holzbecher Z.: Analytická chemie, SNTL, Praha 1974
- Dr. Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- N. N. Greenwood – A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993, ISBN 80-85427-38-9
Reference
- ↑ Výzkum potvrdil přínos selenových brambor – agroweb.cz, 4. 6. 2009
Externí odkazy
- Periodická soustava a tabulka vlastností prvků
- Chemický vzdělávací portál
- Periodická tabulka prvků
- (anglicky) WebElements
|
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |
