Multimediaexpo.cz je již 18 let na českém internetu !!
Palivový článek
Z Multimediaexpo.cz
m (Nahrazení textu „<math>“ textem „<big>\(“) |
m (Nahrazení textu „</math>“ textem „\)</big>“) |
||
| Řádka 36: | Řádka 36: | ||
Palivo (například [[vodík]]) je na [[anoda|anodě]] katalyticky přeměněno na kat[[ion]]ty (v příp. vodíku ionty H<sup>+</sup>). Uvolněné [[elektron]]y jsou navázány anodou a vytváří [[elektrický proud]], který proudí přes elektrický spotřebič ke [[katoda|katodě]]. Na katodě se oxidační činidlo (většinou [[kyslík]]) redukuje na an[[ion]]ty (O<sup>2-</sup>), a ty pak reagují s H<sup>+</sup> ionty a přeměnují se na vodu. | Palivo (například [[vodík]]) je na [[anoda|anodě]] katalyticky přeměněno na kat[[ion]]ty (v příp. vodíku ionty H<sup>+</sup>). Uvolněné [[elektron]]y jsou navázány anodou a vytváří [[elektrický proud]], který proudí přes elektrický spotřebič ke [[katoda|katodě]]. Na katodě se oxidační činidlo (většinou [[kyslík]]) redukuje na an[[ion]]ty (O<sup>2-</sup>), a ty pak reagují s H<sup>+</sup> ionty a přeměnují se na vodu. | ||
; Chemické rovnice: | ; Chemické rovnice: | ||
| - | <big>\(Anoda: 2 H_2 \to 4 H^+ + 4 e^-</ | + | <big>\(Anoda: 2 H_2 \to 4 H^+ + 4 e^-\)</big> |
; Oxidace / odevzdání elektronu | ; Oxidace / odevzdání elektronu | ||
| - | * <big>\(Katoda: O_2 + 4 e^-\to 2O^{2-}</ | + | * <big>\(Katoda: O_2 + 4 e^-\to 2O^{2-}\)</big> |
| - | * <big>\(2.krok: 2O^{2-} + 4 H^+\to 2 H_2O</ | + | * <big>\(2.krok: 2O^{2-} + 4 H^+\to 2 H_2O\)</big> |
; Redukce / přijmutí elektronu | ; Redukce / přijmutí elektronu | ||
| - | <big>\(Souhrn: 2 H_2 + O_2 \to 2 H_2O</ | + | <big>\(Souhrn: 2 H_2 + O_2 \to 2 H_2O\)</big> |
; Redoxní reakce | ; Redoxní reakce | ||
== Související články == | == Související články == | ||
Aktuální verze z 14. 8. 2022, 14:53
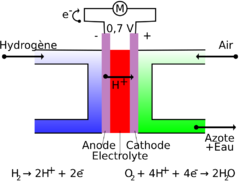
Palivový článek je elektrochemické zařízení vytvářející elektrickou energii. Palivový článek je galvanický článek, k jehož elektrodám jsou přiváděny jednak palivo (k anodě) jednak okysličovadlo (ke katodě). Princip výroby elektřiny v palivovém článku spočívá tedy v dodávání paliva k anodě (do anodového prostoru) a okysličovadla ke katodě (do katodového prostoru). Mezi těmito dvěma neprodyšně oddělenými elektrodovými prostory se nachází elektrolyt. Na katodě se oxidační činidlo (většinou kyslík) redukuje na anionty (O2-), a ty pak reagují s H+ ionty na vodu. Palivové články mohou operovat nepřetržitě, pokud se nepřeruší přívod paliva a okysličovadla k elektrodám. Na rozdíl od obvyklých monočlánků (baterií), ve kterých se elektrody při odběru proudu spotřebovávají, zůstávají elektrody v palivovém článku stálé, avšak spotřebovává se palivo a okysličovadlo, kterými jsou elektrody omývány. Zatímco elektrody uvnitř baterie jsou opotřebovávány, v palivovém článku jsou elektrody katalyticky i relativně stabilní. Existuje mnoho kombinací paliva a okysličovadla. Např. kyslíko-vodíkový článek používá vodík jako palivo a kyslík jako okysličovadlo. Jiné články užívají jako paliva uhlovodíky a alkoholy. Místo čistého kyslíku se jako okysličovadla může použít například vzduch, chlór a oxid chloričitý.
Obsah |
Pozadí
Přeměna chemické energie na elektrickou se většinou děje v generátorech oklikou přes kinetickou energii, která vzniká při spalování daného paliva. Palivové články vyrábějí elektřinu přímo a proto by měly být účinnější, jednodušší a spolehlivější. Zatím však jejich využití částečně brání technické překážky. V současnosti se nejvíce nadějí vkládá do kyslíko-vodíkového palivového článku v rámci vodíkového pohonu automobilů. Vodík může být vyroben např. pomocí elektrolýzy vody a kyslík je obsažen v atmosféře. Skladování vodíku v automobilových nádržích je v neustálém vývoji díky tomu, že vodík je ve směsi se vzduchem vysoce výbušný. Moderní výzkumy ukazují na použití směsi železa a titanu jako stabilizátoru. Navíc účinnost celého cyklu (elektřina → vodík → elektřina) dosahuje jen asi 30-40 %. Elektřina se většinou vyrábí splalováním uhlí a účinnost výroby elektřiny z uhlí 40%. Celkově pak účinnost celého systému uhlí → elektřina → vodík → elektřina je 12-16%. V současnosti jsou palivové články používány v raketoplánech a v ponorkách.
Historie
Princip palivového článku byl objeven už v roce 1838 švýcarským vědcem Christianem Friedrich Schönbeinem. Popsal jej v publikaci, která vyšla v lednu 1839. Na základě této teoretické práce sestavil první fungující prototyp Sir William Growe. Termín „Palivový článek“ patrně použili jako první v roce 1889 Charles Langer a Ludwig Mond, kteří se pokusili vyvinout článek napájený svítiplynem. Jejich článek ale byl příliš drahý. Tvůrcem názvu mohl být i William Jacques, který poprvé zkusil jako elektrolyt použít v článku kyselinu fosforečnou. Po vynálezu dynama Wernerem von Siemensem palivový článek upadl částečně v zapomnění. První použitelný článek o výkonu 5 kW prezentoval jeho vynálezce Francis Thomas Bacon v roce 1959.[1][2] Svou skutečnou renesanci zažil palivový článek v 60. letech 20. století. Bylo to především díky kosmickému výzkumu, protože článek má proti jiným zdrojům výhodnější poměr energie/hmotnost. Byly jimi například vybaveny kosmické lodi programu Apollo, ale jsou zdrojem energie i pro současné raketoplány. Navíc odpadním produktem vodíko-kyslíkového článku je voda, která může byt využita ve vodním režimu raketoplánu.
Typy palivových článků
Palivové články lze třídit dle provozní teploty na nízkoteplotní a vysokoteplotní. Dalším kritériem je použitý elektrolyt
Palivové články s alkalickým elektrolytem (AFC)
Jako elektrolyt se používá vodný roztok alkalického hydroxidu (NaOH, KOH) zafixovaný do azbestové matrice. Jako palivo slouží čistý vodík a jako okysličovadlo čistý kyslík, nebo vzduch zbavený oxidu uhličitého, který by reagoval spolu s elektrolytem na uhličitan draselný. V takovýchto palivových článcích lze použít veliké množství typů katalyzátorů, nejsme tedy odkázání pouze na katalyzátory na bázi platiny. Účinnost přeměny čistého vodíku na elektrickou energii dosahuje až 60%. Tyto palivové články se uplatňují především ve vesmírných a vojenských aplikacích.
Palivové články s polymerní membránou (PEMFC)
Funkci elektrolytu zde plní polymerní membrána vodivá pro vodíkové ionty (protony), někdy se proto používá termín „proton exchange membráne“, která však musí být zvlhčována. V drtivé většině se jedná o sulfonované fluoropolymery, nejčastěji se jedná o Nafion®. Jako katalyzátor se nejčastěji používá platina, nebo slitiny platinových kovů, které jsou nanesené na povrch GDL (plynově difúzní vrstva) a tak vytváří GDE (plynově difúzní elektroda), GDL s zafixovaným katalyzátorem. Jako palivo slouží vodík, nebo metanol a jako okysličovadlo kyslík, nebo vzduch. Pracovní teplota je do 90 °C, což umožňuje okamžité flexibilní použití, nevýhodou je vysoká citlivost katalyzátoru na katalytické jedy, především na oxid uhelnatý. Tento palivový článek se hodí pro mobilní zařízení.
Palivové články s kyselinou fosforečnou (PAFC)
Tyto palivové články jsou již dnes komerčně dostupné. Jako elektrolyt je používána 100% kyselina fosforečná fixovaná v matrici. Tyto palivové články pracují při teplotě okolo 200 °C. Jako katalyzátor je používána platina, kdy v současnosti došlo k významnému poklesu množství použité platiny. Jako palivo slouží vodík připravený parním reformingem fosilních paliv a jako okysličovadlo vzduch. Tyto palivové články skýtají možnost využití v kogeneračních jednotkách.
Palivové články s tavenými uhličitany (MCFC)
Tyto palivové články jsou již dnes komerčně dostupné. Jako elektrolyt zde slouží tavenina směsi alkalických uhličitanů fixovaná v matrici, protože tyto palivové články pracují při teplotě okolo 600 °C. V těchto palivových článcích se nemusí používat drahé katalyzátory, v palivovém článku dochází k vnitřnímu reformingu, který zvyšuje účinnost článku, a proto palivo nemusí být příliš čisté. Jako palivo slouží plyn z parního reformingu fosilních paliv a bioplynu a jako okysličovadlo vzduch. Tyto palivové články skýtají možnost využití v kogeneračních jednotkách a elektrárnách.
Palivové články s tuhými oxidy (SOFC)
Pevný elektrolyt způsobuje konstrukční problémy, ovšem nemusí se zde používat drahých katalyzátorů. Vzhledem k faktu, že tyto palivové články pracují při teplotě okolo 800 °C, lze použít reakční produkty v expanzní turbíně, což vede k dalšímu zvýšení účinnosti. Jako palivo slouží plyn z parního reformingu fosilních paliv a bioplynu a jako okysličovadlo vzduch. Tyto palivové články skýtají možnost využití v kogeneračních jednotkách a elektrárnách.
Struktura
Palivový článek se skládá ze dvou elektrod, které jsou odděleny membránou nebo elektrolytem. K anodě je přiváděno palivo (např. vodík, methan, methanol, kyselina octová, roztok glukózy), které je zde oxidováno. Ke katodě je přiváděno oxidační činidlo (např. kyslík, peroxid vodíku, thiokyanát draselný), které se zde redukuje. Elektrody jsou většinou zhotoveny z různých kovů, nebo může jít o uhlíkové nanotrubičky. Mohou být potaženy katalyzátorem (např. platinou nebo palladiem), čímž se dosahuje vyšší účinnosti. Dnes se standardně používají elektrody s množstvím katalyzátoru 5g/m2. Jako elektrolyt mohou sloužit různé kyseliny (převážně H3PO4) nebo zásady (nejčastěji KOH), keramiky nebo membrány. U specifických palivových článků se používá jako elektrolyt plyn pod vysokým tlakem. Dnes nejpoužívanějším elektrolytem je KOH, který byl použit už u článků v projektu Apollo, jehož nevýhodou však je, že se oxidovadlo musí čistit od CO2, aby nedocházelo k reakci oxidu uhličitého s elektrolytem, neboť vzniklý uhličitan draselný by přestal plnit funkci elektrolytu. Vznikající elektrické napětí je teoreticky okolo 1,23 voltu a závisí na typu paliva a kvalitě článku. U dnes nejpoužívanějších článků dosahuje nejčastěji napětí 0,5 - 0,95 V. Aby se dosáhlo vyššího napětí, zařazuje se více palivových článků do série. Velikost proudu závisí na ploše článku, dnes komerčně dostupné články poskytuji přibliže 0,5W/cm2.
Reakce
Palivo (například vodík) je na anodě katalyticky přeměněno na kationty (v příp. vodíku ionty H+). Uvolněné elektrony jsou navázány anodou a vytváří elektrický proud, který proudí přes elektrický spotřebič ke katodě. Na katodě se oxidační činidlo (většinou kyslík) redukuje na anionty (O2-), a ty pak reagují s H+ ionty a přeměnují se na vodu.
- Chemické rovnice
\(Anoda: 2 H_2 \to 4 H^+ + 4 e^-\)
- Oxidace / odevzdání elektronu
- \(Katoda: O_2 + 4 e^-\to 2O^{2-}\)
- \(2.krok: 2O^{2-} + 4 H^+\to 2 H_2O\)
- Redukce / přijmutí elektronu
\(Souhrn: 2 H_2 + O_2 \to 2 H_2O\)
- Redoxní reakce
Související články
Reference
- ↑ (anglicky)http://www.corrosion-doctors.org/Biographies/BaconBio.htm
- ↑ (anglicky)http://www.ieeeghn.org/wiki/index.php/Bacon%27s_Fuel_Cell
|
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |