Přejeme Vám krásné svátky a 52 týdnů pohody a štěstí v roce 2025 !
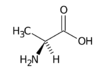
Alanin
Z Multimediaexpo.cz
(+ Výrazné vylepšení) |
m (1 revizi) |
Aktuální verze z 9. 12. 2013, 16:50
| Alanin | |
| Systematický název | (2S)-2-aminopropionová kyselina |
| Triviální název | alanin |
| Registrační číslo CAS | 56-41-7 |
| Sumární vzorec | C3H7NO2 |
| Molární hmotnost | 89,1 g/mol |
| Teplota tání | 297 °C |
| Disociační konstanta | pKCOOH: 2,35 pKNH2: 9,87 |
| Isoelektrický bod | 6,11 |
| Hustota | 1.401 g.cm-3 |
Alanin (Ala,A) je nepolární, neesenciální α-aminokyselina. Na jeho α-uhlík je navázána metylová skupina což z něj dělá jednu z nejjednodušších α-aminokyselin. Alanin je vůbec nejobvyklejší aminokyselinou v proteinech.[1]
Obsah |
Fyziologická funkce
| Průměrný výskyt | 9,0% |
| kodóny | GCU, GCC, GCA, GCG |
Chemické vlastnosti
Alanin obsahuje, podobně jako většina aminokyselin, chirální uhlík, je tedy opticky aktivní. Vyskytuje se ve dvou formách (enantiomerech): L-alanin a D-alanin, v tělech živočichů je však přítomen pouze v L-formě.
V bílkovinách
Methylová skupina je nereaktivní, proto se alanin se téměř nikdy nepodílí na funkci proteinu přímo. Podílí se (spolu s některými dalšími aminokyselinami) na hydrofobních interakcích napříč vláknem proteinu.
Alaninový cyklus
Alanin se kromě výstavby proteinů také podílí na dopravě amoniaku ze svalů do jater a na glukoneogenezi v tzv. alaninovém cyklu, ve kterém je z pyruvátu transaminací ve svalu vytvořen alanin, který je pak dopraven krví do jater, kde je opět transaminován za vzniku pyruvátu. Přenesená aminoskupina je pak pomocí močovinového cyklu přeměněna na močovinu (a vyloučena z těla ven), zatímco pyruvát slouží jako prekurzor pro syntézu glukózy v procesu glukoneogeneze.
Vztah k hypertenzi
Podle mezinárodní studie Imperial College London existuje korelace mezi hladinou alaninu, vysokým krevním tlakem, příjmem energie, hladinou cholesterolu a indexem tělesné hmotnosti.[2]
Zdroje
V potravinách
Alanin není esenciální tedy při nedostatku může být v těle vytvořen. Zdrojem alaninu jsou veškerá bílkovinná jídla, např. maso, vajíčka, mléčné výrobky nebo plody moře. Z vegetariánských jídel hodně alaninu obsahují luštěniny, ořechy, kvasnice, hnědá rýže nebo obilí.
Biosyntésa
Alanin může být v těle tvořen z pyruvátu nebo z aminokyselin s větveným alifatickým řetězcem tedy například z valinu, leucinu a izoleucinu. Nejběžněji je alanin tvořen transaminací pyruvátu, který vzniká glykolýzou glukózy. Protože transaminační reakce jsou reverzibilní a pyruvát všudypřítomný, alanin snadno vzniká v úzké vazbě s metabolickými drahami jako glykolýza, glukogeneze a citrátový cyklus.
Chemická syntéza
Racemická směs alaninu se dá připravit kondenzací acetaldehydu s chloridem amonným za přítomnosti kyanidu draselného Streckerovou syntézou nebo amonolýzou kyseliny 2-brompropionoé:[3]
Související články
Reference
- ↑ ŠTERN, Petr, a kolektiv Obecná a klinická biochemie pro bakalářské obory studia. Praha : Karolinum, 2005.
- ↑ Highfield, Roger (2008-04-21), "'Metabolic fingerprint' linked to high blood pressure", Daily Telegraph, http://www.telegraph.co.uk/earth/main.jhtml?view=DETAILS&grid=&xml=/earth/2008/04/21/sciblood121.xml
- ↑ Kendall, E. C.; McKenzie, B. F. (1929), "dl-Alanine", Org. Synth. 9: 4, ; Coll. Vol. 1: 21
Literatura
- Voet D., Voet JG, Pratt CW, "Fundamentals of biochemistry, life at molecular level" 2nd edition, 2006 John Wiley and Sons (Asia) Pte Ltd, ISBN 0-471-74268-6
- MURRAY, Robert K., et al. Harperova biochemie. Z angl. 23. vyd. přel. Lenka Fialová et. al. 4. vyd. v ČR. Praha: H & H, 2002. ix, 872 s. ISBN 80-7319-013-3.
| Aminokyseliny |
|---|
|
Alanin • Arginin • Asparagin • Cystein • Fenylalanin • Glutamin • Glycin • Histidin • Isoleucin • Kyselina asparagová • Kyselina glutamová • |
| Speciální aminokyseliny |
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |