Hliník
Z Multimediaexpo.cz
(+ Vylepšení) |
m (1 revizi) |
Aktuální verze z 30. 5. 2014, 11:52
| Hliník | |
| |
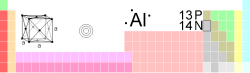
| Atomové číslo | 13 |
| Relativní atomová hmotnost | 26.9815386 amu |
| Stabilní izotopy | 27 |
| Elektronová konfigurace | [Ne] 3s2 3p1 |
| Skupenství | Pevné |
| Teplota tání | 660,32 °C, (933,47 K) |
| Teplota varu | 2 519 °C, (2 792 K) |
| Elektronegativita (Pauling) | 1,61 |
| Hustota | 2,70 g/cm3 |
| Hustota při teplotě tání | 2,375 g/cm3 |
| Registrační číslo CAS | 7429-90-5 |
Hliník, chemická značka Al, (lat. Aluminium), je velmi lehký kov bělavě šedé barvy, velmi dobrý vodič elektrického proudu, široce používaný v elektrotechnice a ve formě slitin v leteckém průmyslu a mnoha dalších aplikacích.
Obsah |
Základní fyzikálně - chemické vlastnosti
Neušlechtilý stříbřitě šedý, nestálý, kujný kov, elektricky velmi dobře vodivý. V přírodě se vyskytuje zejména ve formě sloučenin, nejznámější rudou je bauxit Al2O3 . 2 H2O (dihydrát oxidu hlinitého). Ve sloučeninách se vyskytuje pouze v mocenství Al+3. V kyselém prostředí jako hlinitý kation, v alkalickém prostředí jako hlinitanový anion [AlO2]-. Hliník je v čistém stavu velmi reaktivní, na vzduchu se však rychle pokryje tenkou vrstvičkou oxidu Al2O3, která chrání kov před další oxidací. Hliník je velmi dobře rozpustný ve zředěných kyselinách, koncentrovaná kyselina dusičná jej však stejně jako vzdušný kyslík pokryje pasivační vrstvou oxidu. Také hydroxidy alkalických kovů snadno rozpouštějí kovový hliník za vzniku hlinitanů (AlO2)-. Hliník byl objeven roku 1825 dánským fyzikem Hansem Christianem Oerstedem.
Výskyt v přírodě
Díky velké reaktivitě hliníku se v přírodě setkáváme prakticky pouze s jeho sloučeninami. Hliník je třetím nejvíce zastoupeným prvkem v zemské kůře. Podle posledních dostupných údajů tvoří hliník 7,5–8,3 % zemské kůry. V mořské vodě je jeho koncentrace velmi nízká, pouze 0,01 mg Al/l a ve vesmíru připadá na jeden atom hliníku přibližně půl milionu atomů vodíku.
Nejběžnější horninou na bázi hliníku je bauxit, Al2O3 · 2 H2O. Obvykle bývá doprovázen dalšími příměsemi na bázi oxidů křemíku, titanu , železa a dalších. Jiným významným minerálem je kryolit, hexafluorohlinitan sodný Na3AlF6, používaný především jako tavidlo pro snížení teploty tání bauxitu. Minerály na bázi oxidu hlinitého Al2O3 patří mezi velmi významné i ceněné. Korund je na 9. místě Mohsovy stupnice tvrdosti. Technický oxid hlinitý se nazývá také elektrit a je hojně využíván k výrobě brusného papíru.
- Drahé kameny, jejichž základním materiálem je oxid hlinitý se liší příměsí, která způsobuje jejich charakteristické zbarvení. Červený rubín je zbarven příměsí oxidu chromu, modrý safír obsahuje především stopová množství oxidů titanu a železa.
- Obě zmíněné formy korundu patří k nejvíce ceněným drahým kamenům na světě, ale mají i významné využití v technice. Safírové hroty vynikají svou tvrdostí a odolností a vybavují se jimi špičkové vědecké měřicí přístroje. Rubín je znám jako materiál pro konstrukci prvního laseru na světě. Titan-safírový laser vyniká extrémně krátkými pulsy (< 50 fs)
Výroba
Přestože hliník patří mezi prvky nejvíce zastoupené v zemské kůře, patřila jeho průmyslová výroba do ještě poměrně nedávné doby k velmi obtížným procesům. Je to především z toho důvodu, že elementární hliník nelze jednoduše metalurgicky vyredukovat z jeho rudy jako např. železo koksem ve vysoké peci. Teprve zvládnutí průmyslové elektrolýzy taveniny kovových rud umožnilo současnou mnohasettunovou roční produkci čistého hliníku. Při elektrolýze se z taveniny směsi předem přečištěného bauxitu a kryolitu o teplotě asi 950 °C na katodě vylučuje elementární hliník, na grafitové anodě vzniká kyslík, který ihned reaguje s materiálem elektrody za vzniku toxického plynného oxidu uhelnatého, CO.
Patrně největší hliníkárnou ve střední Evropě je závod ve slovenském Žiaru nad Hronom, kam se převážná většina bauxitu dováží z Maďarska.
Využití kovového hliníku
Předměty denní potřeby
Kovový hliník nalézá uplatnění především díky své poměrně značné chemické odolnosti a nízké hmotnosti. Proto se z něj vyrábějí např. některé drobné mince, ale i běžné kuchyňské nádobí a příbory. Po vyválcování do tenké folie se s ním setkáme pod názvem alobal při tepelné úpravě pokrmů nebo jako ochranného obalového materiálu pro nejrůznější aplikace. Společně se stříbrem slouží hliník ve formě velmi tenké folie jako záznamové médium v kompaktních discích (CD) ať již pro záznam zvuku nebo jako paměťové médium ve výpočetní technice. Tato vrstva se na plastový podklad obvykle naprašuje tichým elektrickým výbojem ve vakuu.
Hliník jako vodič
Vzhledem k dobré elektrické vodivosti se kovového hliníku dříve často využívalo jako materiálu pro elektrické vodiče. Hliník se však průchodem elektrického proudu zahřívá a zvětšuje svůj objem. Pokud je hliníkový vodič spojen mechanicky s jiným vodičem kupříkladu pomocí šroubu, pak toto roztažení nemůže probíhat všemi směry stejně. Při ochlazení, tedy když proud přestane vodičem protékat, se naopak smrští rovnoměrně ve všech směrech, což způsobí, že se šroubované kontakty poněkud uvolní, čímž se zvýší jejich odpor, který následně vede ke zvýšenému zahřívání. Doporučuje se proto hliníkové kontakty občas dotahovat, aby se zmenšilo nebezpečí vzniku požáru.
Aluminotermie
Díky své elektropozitivitě má hliník značnou afinitu ke kyslíku a ochotně s ním reaguje. Této vlastnosti využívá aluminotermie - metoda výroby některých kovů z jejich oxidů za použití hliníku jako redukčního činidla. Při uvedené reakci se také uvolňuje značné množství tepla a teplota dosahuje dostatečných hodnot pro roztavení např. kovového železa. Následující reakce práškového hliníku s oxidem železitým se dříve často používalo ke spojování železných kolejnic vzniklým roztaveným železem.
- 2 Al + Fe2O3 → Al2O3 + 2 Fe
Práškový hliník se používá také jako složka některých trhavin, protože svoji přítomností zvyšuje teplotu exploze i brizanci výbušniny.
Slitiny hliníku
Nejdůležitější je však uplatnění hliníku ve formě slitin, z nichž bezesporu nejznámější je slitina s hořčíkem, mědí a manganem, známá jako dural. Tento materiál má oproti samotnému hliníku mnohem větší pevnost a tvrdost při zachování velmi malé měrné hmotnosti. Zároveň jsou i značně odolné vůči korozi. Všechny uvedené vlastnosti předurčují dural jako ideální materiál pro letecký a automobilový průmysl, ale setkáme se s ním při výrobě výtahů, jízdních kol, lehkých žebříků a podobných aplikacích.
Sloučeniny hliníku a jejich význam
Bezesporu nejvýznamnější sloučeninou hliníku je oxid hlinitý, Al2O3. Tato látka se vyskytuje v řadě modifikací se zcela odlišnými fyzikálně chemickými vlastnostmi.
- Krystalický Al2O3 má název korund a k jeho základním vlastnostem patří mimořádná tvrdost a chemická odolnost. V přírodě se nachází v řadě různých modifikací, drahokamy safír a rubín jsou zmíněny v předchozí kapitole. Uměle vyráběný korund nalézá řadu praktických uplatnění, od výroby laserů po osazování hlavic geologických vrtačních souprav a kovoobráběcích nástrojů pro práci s mimořádně odolnými materiály.
- Chemicky připravený oxid hlinitý se označuje názvem alumina. Podle podmínek výroby vykazuje tento materiál různé fyzikální vlastnosti, základní typy aluminy se označují jako alfa, beta a gama. Nejvýznamnější uplatnění nalézá alumina v chemickém průmyslu jako inertní nosič katalyzátorů v organické i anorganické syntéze. Příkladem mohou být hydrogenační katalyzátory na bázi elementární platiny, pracující za teplot přes 300 °C a tlaků desítek atmosfér. I za těchto extrémních podmínek dosahuje životnost těchto katalytických systémů stovek až tisíců pracovních hodin.
- Speciálně upravená alumina nanesená v tenké vrstvě na inertním nosiči slouží pro separaci organických sloučenin tzv. chromatografií na tenké vrstvě. Tato analytická technika je ekonomicky velmi nenáročná a nalézá uplatnění např. v kontrole průmyslového dělení směsí přírodních barviv a dalších typů sloučenin.
Chlorid hlinitý, AlCl3 je velmi významný průmyslový katalyzátor v oboru organické syntézy. Uplatňuje se zde jako Lewisovská kyselina, jejíž působením dochází vnášení alkylových skupin na aromatické jádro nebo halogenaci uhlovodíků do předem zvolené polohy. Reakce tohoto typu jsou souborně označovány termínem Friedel-Craftsovy reakce, klasickým příkladem je výroba toluenu reakcí chloroformu s benzenem nebo syntéza styrenu z ethenu a benzenu. Fluorid hlinitý, AlF3 a fosforečnan hlinitý AlPO4 patří mezi velmi málo rozpustné sloučeniny hliníku. V analytické chemii slouží k vážkovému (gravimetrickému) stanovení obsahu hliníku v roztoku a fosfátový ion může odstraňovat i malá množství hliníku z odpadních a průmyslových vod. Octan hlinitý, Al(CH3COO)3 se používá v lékařství jako účinná látka v mastech proti otokům.
Zdravotní rizika
Velmi zvláštní až kuriózní je fakt, že hliník téměř jako jediný z prvků I. - III. základní skupiny prvků periodické soustavy se prakticky nevyskytuje v žádné živé tkáni, ať již rostlinné nebo živočišné. Existuje dokonce silné podezření, že případný zvýšený výskyt hliníku v krvi může být příčinou vzniku Alzheimerovy choroby tím, že likviduje mozkové a nervové buňky. Tento předpoklad nebyl doposud prokázán, přesto je však na obsah hliníku velmi pečlivě testována především krevní plazma, která by při pravidelných krevních transfuzích mohla zvýšit hladinu hliníku v krvi pacienta. Obdobná pravidla platí pro všechny dialyzační roztoky, používané při chronickém selhání ledvin.
Poměrně diskutovaným problémem je riziko používání hliníkového nádobí a příborů při přípravě a konzumaci potravy. Je pravda, že v podmínkách, kdy se potraviny běžně tepelně upravují i konzumují, je hliník nejstálejší a prakticky nerozpustný. V neutrálním prostředí běžné pitné vody o pH = 7 je hliníkový povrch perfektně stabilní a bezpečný. Problém nastává, když je např. vařený pokrm okyselen octem. Kromě toho se v poslední době stále mírně zvyšuje kyselost pitné vody, především v důsledku kyselých dešťů. Pak může skutečně nastat situace, kdy se z hliníkových nádob bude uvolňovat hliník při každém použití a jejich rizikovost poroste. Na druhé straně je organizmus vybaven řadou bariér, které brání pronikání sloučenin hliníku do tělesných tekutin a buněk.
Literatura
- Cotton F.A., Wilkinson J.:Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973
- Holzbecher Z.:Analytická chemie, SNTL, Praha 1974
- Dr. Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- N. N. Greenwood - A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993 ISBN 80-85427-38-9
Externí odkazy
- Chemický vzdělávací portál chemie.gfxs.cz
- webelements.com (anglicky)
- Periodická tabulka prvků na tabulka.cz
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |




