Dusičnan amonný
Z Multimediaexpo.cz
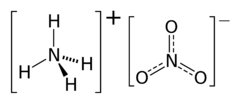
Dusičnan amonný, triviálním názvem ledek amonný či amoniumnitrát, je chemická sloučenina (dusičnan amoniaku) s chemickým vzorcem NH4NO3.
Je to bílá krystalická látka používaná jako zemědělské hnojivo a díky oxidačním vlastnostem také v pyrotechnice.
Obsah |
Bezpečnost
Dusičnan amonný se při zahřátí bezvýbušně rozkládá na oxid dusný („rajský plyn“) a vodní páru:
- NH4NO3 → N2O + 2 H2O
Jestliže však dojde k detonaci, je tento rozklad doprovázen výbuchem. Velké zásoby této látky mohou být také požárním rizikem, protože podporuje hoření, což může snadno vést až právě k detonaci. Výbuchy dusičnanu amonného nejsou vzácným jevem, k méně závažným případům dochází téměř každoročně. Zaznamenáno však bylo i několik rozsáhlých, zničujících výbuchů, k nimž se řadí:
- Exploze chemičky v Oppau (dnes součást města Ludwigshafen) v Německu 21. září 1921 (jeden z nejničivějších vyvolaných nenukleárních výbuchů v dějinách)
- Neštěstí v Texas City (přístav v Mexickém zálivu) v USA 16. dubna 1947
- Exploze chemičky AZF v Toulouse, Francie 21.září 2001[1]
- Exploze v továrně Adair Grain, West (TX), USA, 17.dubna 2013 [2]

- Exploze v Tchien-ťinu (přístav ve Žlutém moři) v Číně 12. srpna 2015
- Výbuch v přístavu v Bejrútu (Středozemní moře) v Libanonu 4. srpna 2020 [3]
S ohledem na svou výbušnost je dusičnan amonný uveden v seznamu látek považovaných za prekurzory výbušnin, jejichž prodej nepodnikajícím fyzickým osobám podléhá v Evropské unii dozoru, aby bylo zabráněno jejich zneužití k nedovolené výrobě výbušnin.[4] Dusičnan amonný nelze podle tohoto nařízení prodávat ani držet samostatně ani ve směsích či látkách, v nichž je koncentrace dusíku pocházejícího z dusičnanu amonného větší nebo rovna 16 % hmotnostním.
Příprava
Dusičnan amonný může vznikat přeměnou močoviny:
Obvykle se však připravuje reakcí kyseliny dusičné a čpavku:[5]
- HNO3 + NH3 → NH4NO3
Dusičnan amonný se také vyrábí amatérskými nadšenci reakcí:
- Ca(NO3)2 + (NH4)2SO4 → 2 NH4NO3 + CaSO4
Tato reakce je silně exotermní. Lze ho také připravit reakcí AgNO3(aq) s NH4Cl(aq), přičemž vzniká jako nerozpustná sůl AgCl, která se dá odfiltrovat, takže výtěžek je pak poměrně vysoký.
Využití
- V zemědělství jako hnojivo
- V pyrotechnice
- Složka explosivní náplně některých bomb, např. BLU-82
Reference
- ↑ Ve Francii začíná soudní proces století. Česká televize [online]. . Dostupné online.
- ↑ Příčina výbuchu ledek. Bejrút není první podobný případ. Seznam Zprávy [online]. . Dostupné online.
- ↑ Výbuch v Bejrútu: Lidé hledají blízké, na místo míří zahraniční pomoc - Seznam Zprávy. www.seznamzpravy.cz [online]. [cit. 2020-08-05]. Dostupné online.
- ↑ Nařízení Evropského parlamentu a Rady (EU) 2019/1148 ze dne 20. června 2019 o uvádění prekurzorů výbušnin na trh a o jejich používání, změně nařízení (ES) č. 1907/2006 a zrušení nařízení (EU) č. 98/2013. EUR-Lex [online]. [cit. 2020-08-04]. Dostupné online. ( )
- ↑ Process_of_producing_concentrated_soluti
Literatura
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5.
|
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |