The final launch of the Allmultimedia.org will take place on February 27, 2026
(shortly after the 2026 Winter Olympics).
Adenosintrifosfát
Z Multimediaexpo.cz
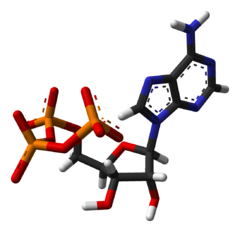
Adenosintrifosfát (ATP, zkratka z angl. adenosine triphosphate) je důležitý nukleotid[1] (resp. nukleosidtrifosfát), který se skládá z adenosinu a trojice fosfátů navázané na 5' uhlíku. Je zcela zásadní pro funkci všech známých buněk.[2] Jeho význam spočívá v tom, že při rozkladu ATP na ADP a Pi dochází k uvolnění značného množství energie. Tato energie se využívá téměř ve všech typech buněčných pochodů, jako je namátkou celá řada biosyntetických pochodů, vnitrobuněčný transport a membránový transport, výroba proteinů či syntéza RNA. ATP se z chemického hlediska řadí mezi tzv. 5' ribonukleotidy, které obsahují cukr ribózu a na 5' místě fosfátové skupiny. Existují i další nukleotidy s podobnou stavbou a funkcí (např. GTP, UTP), žádný však nemá tak všestranné využití jako ATP.[1] Od ATP je tedy vhodné odlišovat vzácnější deoxyadenosintrifosfát (dATP), jenž patří mezi deoxyribonukleotidy a představuje v podstatě jeden ze základních stavebních kamenů DNA.[1]
Obsah |
Historie výzkumu
Adenosintrifosfát byl v roce 1929 K. Lohmannem poprvé izolován z extraktu svalu.[1][3] Až v roce 1941 ale Fritz Albert Lipmann navrhl, že je ATP hlavní biomolekulou, jež umožňuje krátkodobé uchování a udílení energie v buňkách.[4] ATP bylo poprvé uměle připraveno Alexanderem Toddem v roce 1948.[5] V roce 1949 ukázal Albert Szent-Györgyi, že svalový stah izolovaných myofibril může být uměle vyvolán přidáním ATP. O několik let později byla podobným experimentem popsána role ATP v pohybu řasinek.[2]
Struktura a vlastnosti
Adenosintrifosfát je nukleotid složený z pětiuhlíkatého cukru ribózy, adeninu navěšeného na 1' uhlíku a trojice fosfátových skupin na 5' uhlíku. Vazba mezi adeninem a ribózou se označuje jako N-glykosidická. Fosfátové skupiny jsou připojeny mezi sebou anhydridovými vazbami a k ribóze tzv. fosfodiesterovou vazbou. Často se uvádí, že anhydridové vazby mezi fosfáty jsou bohaté na energii či makroergické a znázorňují se vlnovkami: Ade–Rib–P~P~P.[6] To je nicméně zavádějící a vysokoenergetičnost vazby v žádném případě přímo nesouvisí s danou vazebnou energií. Na druhou stranu je právě přenos fosfátových skupin spojován s uvolňováním značné energie, a tak je termín „makroergická vazba“ do jisté míry opodstatnitelný.[7] Fyzikálně-chemické vlastnosti ATP se podobají vlastnostem jiných nukleotidů. Jedná se o bílou práškovitou látku[8] rozpustnou ve vodě, s několika záporně nabitými skupinami. Absorbuje záření v ultrafialové oblasti kolem 260 nm.[1]
Význam
V biochemii je ATP znám jako nejběžnější energetické oběživo živých systémů (uvnitř buněk),[6] protože je schopen při svém vzniku do své struktury vratně uschovat relativně velké množství energie, kterou je možno exergonickým (energii uvolňujícím) rozkladem pohánět jiné, endergonické (energii spotřebovávající) procesy. Je to proto tzv. makroergická sloučenina. V rámci celé řady biochemických pochodů dochází k tzv. spotřebě ATP, tedy jeho hydrolýze na ADP + Pi, případně dokonce na AMP a PPi:[6][pozn 1]
- ATP + H2O → ADP + Pi
- ATP + H2O → AMP + PPi
Mimobuněčný ATP má funkci i jako neurotransmiter (viz kapitola výskyt).
Energetika ATP
K reakcím spřaženým se spotřebou (hydrolýzou) ATP patří celá řada fundamentálních chemických procesů probíhajících v buňkách. Bez spřažení s hydrolýzou ATP by tyto reakce probíhaly jen velice pomalu (měly by vysokou hodnotu změny Gibbsovy energie, ΔG). Příkladem je první krok glykolýzy, přeměna glukózy na glukóza-6-fosfát. Reakce glukózy s anorganickým fosfátem má ΔG = +13,8 (kJ/mol), nicméně s ní spřažená hydrolýza ATP se vyznačuje změnou Gibbsovy energie ΔG = -30,5, a tak je celý sled reakcí energeticky favorizovaný a proběhne.[6] Přesná hodnota ΔG pro hydrolytický rozklad ATP na ADP a Pi je závislá na celé řadě faktorů. Vliv má zejména pH, koncentrace dvojmocných kovových iontů (jež se asociují s fosfátem) a celková iontová síla v prostředí. Obvykle se v mnoha reakcích udává standardní změna Gibbsovy energie (ΔG°') -30,5 kJ/mol, ačkoliv v buněčném prostředí je reálnější hodnota -50 kJ/mol.[6] I takto vysoký energetický schodek nemusí pro průběh řady reakcí stačit, nicméně ještě existuje alternativa. Rozklad ATP na AMP a PPi je doprovázen vyšší hodnotou ΔG: samotná hydrolýza na tyto produkty sice poskytne podobné množství energie, jako hydrolýza na ADP,[6] ale do konečného ΔG se započítává i hydrolýza volného difosfátu (PPi), takže výsledná ΔG°' může činit až 109 kJ/mol.[2] Co je ve skutečnosti příčinou energetického schodku při hydrolýze ATP na produkty s nižším počtem fosfátů, to je předmětem dohadů. Zřejmě má vliv celá řada faktorů. Fosfátové skupiny v ATP jsou silně záporně nabité a vzájemně se elektrostaticky odpuzují; hydrolýza snižuje velikost těchto sil. Navíc mají fosforečnany silnou tendenci asociovat se s rozpouštědlem (vodou) – to je mnohem snažší u produktů hydrolýzy. Konečně zřejmě je díky hydrolýze ATP uspokojena poptávka fosfátových skupin po elektronech, které jinak v ATP musí sousední fosfáty sdílet.[6] Nejvyšší význam má zřejmě druhý jmenovaný efekt.[9]
Role v živých systémech
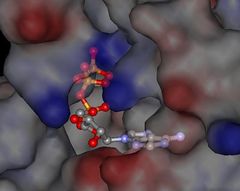
ATP slouží jako substrát pro skupinu enzymů zvaných kinázy. Tyto enzymy, patřící mezi transferázy, přenáší fosfátový zbytek na cílovou molekulu (jako je např. aminokyselinový zbytek v případě proteinkináz). ATP může být chápán jako kofaktor, jenž přenáší funkční skupinu atomů (fosfát) a následně se opět regeneruje. Většina kináz rozkládá ATP na ADP a Pi, lze však přenášet i difosfát (za současného vzniku AMP) a výjimečně adenosylový zbytek za současného uvolnění difosfátu a monofosfátu do prostředí.[10] Reakce katalyzované kinázami jsou obvykle víceméně jednosměrné, protože se při hydrolýze ATP nevratně uvolňuje velké množství volné energie do okolí.[2][pozn 2] Jiný princip využívá celá řada ligáz: ty mnohdy hydrolyzují ATP (mají ATPázovou aktivitu) a uvolněná energie je využita k provedení ligační reakce (typu A + B).[10] ATP je (společně s GTP, CTP a UTP) jedním ze substrátů pro syntézu RNA (transkripci). V rámci čtyř zmíněných nukleotidů nemá nicméně žádnou výlučnou roli a začleňuje se jako AMP do prodlužujícího se řetězce RNA za současného uvolňování pyrofosfátu do prostředí.[2] Vazba ATP do vazebného místa enzymů může mít i důležitou regulační funkci. ATP může totiž působit jako alosterický regulátor, který je schopný změnit prostorovou strukturu enzymu a například ho aktivovat či naopak deaktivovat. Enzymy jsou někdy nastaveny tak, aby vázaly ATP a hydrolyzovaly ho (ATPázy), což může například udělovat energii k mechanické práci enzymů či ke koordinovanému pohybu molekulárních motorů (myosin).[2] Dále ATP slouží i jako substrát pro adenylátcyklázu, která vytváří z ATP cyklický adenosinmonofosfát (cAMP).
Výskyt
Většina ATP v těle mnohobuněčných organismů se vyskytuje vnitrobuněčně, jen zanedbatelné množství ATP se nachází i mimo vlastní buňky v extracelulárním prostoru. Koncentrace ATP v buňkách se liší druh od druhu a v rámci jednoho těla tkáň od tkáně. Koncentrace ATP v buňkách v některých případech zvláštním způsobem pravidelně kolísá, jindy zase vzrůstá v průběhu dozrávání buněk. Dokonce i v rámci jednoho buněčného typu se koncentrace ATP liší při srovnání několika jedinců až dvojnásobně.[11] Zhruba však vnitrobuněčná koncentrace ATP činí 1–10 mmol/litr (mM).[12] Méně známou skutečností je to, že ATP se vyskytuje i mimo buňku, například v tkáňovém moku či v krvi. Ven z buněk se ATP může dostat buď v důsledku poranění (z umírajících buněk), ale mnohdy se to děje i za normálních okolností například pomocí speciálních membránových kanálů či exocytózou pomocí váčků např. na synaptické štěrbině. V některých tkáních tak může i mimo buňku nabývat koncentrace ATP nanomolárních (nM) či dokonce mikromolárních (µM) koncentrací. Extracelulární ATP má celou řadu funkcí a váže se na P1 a P2 receptory buněk. V nervové soustavě někdy slouží jako pomocný neurotransmiter hrající důležitou roli v procesech paměti, učení a vnímání bolesti. V hladké svalovině ovlivňuje kontrakci, ve varlatech má vliv na uvolňování testosteronu. Dosud byly objeveny desítky fyziologických rolí mimobuněčného ATP.[13]
Doplňování hladiny ATP
Může-li hydrolýza ATP poskytovat energii pro průběh celé řady reakcí, pak musí existovat i způsob, jak za pomoci ještě energeticky bohatších látek doplňovat zásobu ATP.[pozn 3] ATP musí být neustále regenerováno ve fosforylačních buněčných reakcích, při nichž obvykle dochází k rozkladu energeticky bohatých organických látek. V žádném případě neslouží ATP jako dlouhodobá zásobárna energie „na horší časy“. Kdyby se ATP neustále nedoplňovalo, došly by jeho zásoby v průměrné savčí buňce po jedné či dvou minutách. Každá buňka tedy za sekundu spotřebuje asi 10 milionů (107) molekul ATP, celé lidské tělo každou minutu rozloží asi 1 gram ATP.[2][pozn 4] V extrémních případech samozřejmě potřeba ATP roste. Bylo spočítáno, že svaly maratonského běžce Channučiho za přibližně dvě hodiny běhu spotřebovaly (rozložily) kolem 60 kg ATP, tedy více, než on sám vážil.[14] Příčinou tohoto zdánlivého paradoxu je fakt, že každá molekula ATP byla mnohokrát ve svalech spotřebována na ADP a následně byl ADP opětovně fosforylován na nové ATP. Naopak ve spánku se potřeba ATP (ve srovnání s bděním) někdy až stonásobně snižuje.[6]
Rozklad a biosyntéza
ATP jako takový se obvykle recykluje vždy po své hydrolýze na ADP či AMP. Část těchto nukleotidů nicméně podléhá rozkladu na nukleosid adenosin, ten se rozkládá na adenin a ribózu. Adenin se rozkládá na urát. Odbourané nukleotidy se samozřejmě musí stále doplňovat, což se děje složitou biosyntetickou cestou, při níž je purinový skelet adeninu sestavován ze sedmi různých „dílů“. Nejprve se vytvoří cukerná a fosfátová část molekuly, načež se teprve začne skládat adenin.[1]
Regenerace
Většina ATP se po svém rozkladu na ADP či AMP obvykle znovu regeneruje opětovným dodáním koncových fosfátových skupin. Co se týče AMP, obvykle dochází k reakci AMP + ATP → 2ADP (za katalýzy adenylylkinázou). Hladina ADP by tedy v buňkách postupně vzrůstala, protože ATP se neustále spotřebovává.[15] Existuje nicméně několik mechanismů, které zajišťují fosforylaci ADP na ATP. V buňkách existuje i negativní zpětná vazba, která zajišťuje, že když je hladina ADP v buňce příliš vysoká, dochází k aktivaci enzymů podílejících se na oxidaci cukrů: to stimuluje regeneraci ATP z ADP.[2] Jednou z možností je tzv. fosforylace na substrátové úrovni, která je obvykle součástí raných fází metabolismu cukrů, nicméně pro některé mikroorganismy představuje jedinou možnost syntézy ATP.[1] V glykolýze vzniká ATP účinkem fosfoglycerátkinázy při přeměně 1,3-bisfosfoglycerátu na 3-fosfoglycerát a dále účinkem pyruvátkinázy při přeměněně fosfoenolpyruvátu na pyruvát. V Krebsově cyklu přímo ATP zpravidla nevzniká, ale v reakci katalyzované sukcinyl-CoA-syntetázou dochází ke vzniku GTP, jenž může být snadno na ATP převeden: ADP + GTP ⇆ ATP + GDP.[6] Speciální možností je vznik ATP ve svalech přenosem fosfátové skupiny z kreatinfosfátu (resp. argininfosfátu) na ADP za vzniku ATP a kreatinu (resp. argininu) – tato reakce vytváří pohotovou zásobu energie v průběhu svalové práce.[1] Tyto všechny jmenované metody však zpravidla nemají takový význam, jako reakce odehrávající se v mitochondriích a plastidech, případně na prokaryotických cytoplazmatických membránách.[6] Ve všech případech jde o to nějakým způsobem vytvořit protonový gradient napříč membránou. Tento gradient protonů podle chemiosmotické teorie vytváří dostatečný zdroj energie pro činnost enzymu ATP syntázy, což je molekulární motor umožňující regeneraci ATP z ADP. Způsobů, jak vytvořit protonový gradient, je celá řada a k nejvýznamnějším patří zejména světelná fáze fotosyntézy (a na ni navazující fotofosforylace), dýchací řetězec jako součást buněčného dýchání, případně činnost bakteriorhodopsinu některých archebakterií. Fotosyntetické pochody se odehrávají v chloroplastech, dýchací řetězec probíhá v mitochondriích či na buněčné membráně prokaryot.
Literatura
- VOET, Donald; VOET, Judith. Biochemie. 1.. vyd. Praha : Victoria Publishing, 1995. ISBN 80-85605-44-9.
- VODRÁŽKA, Zdeněk. Biochemie. Praha : Academia, 2007. ISBN 978-80-200-0600-4.
Poznámky
- ↑ Přičemž Pi je zkratka pro monofosfát (PO43-) a PPi je difosfát (též pyrofosfát, P2O72-).
- ↑ V průběhu takové hypotetické enzymatické reakce by musel spontánně vzniknout ATP z ADP a Pi, což je nereálné. Pro průběh opačné reakce, defosforylace, se tedy využívá zcela odlišná třída enzymů, tzv. fosfatázy.
- ↑ Jedním ze způsobů je například reakce fosfoenolpyruvátu s ADP za vzniku ATP a pyruvátu. Sled dílčích reakcí má celkově exergonický průběh (ΔG = -31,4).[6] Z dalších sloučenin schopných fosforylovat ADP je možné jmenovat acylfosfáty, karbamoylfosfát, 1,3-bisfosfoglycerát, atp.[1]
- ↑ Tzn. buněčný pool ATP je poměrně malý a turnover musí být nutně vysoký.
Reference
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 VODRÁŽKA, Zdeněk. Biochemie. Praha : Academia, 2007. ISBN 978-80-200-0600-4.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 ALBERTS, Bruce , et al.. The Molecular Biology of the Cell. [s.l.] : Garland Science, 2002. (4th. ed.) ISBN 0-8153-3218-1.
- ↑ LOHMANN, K. Über die Pyrophosphatfraktion im Muskel. Naturwissenschaften, srpen 1929, roč. 17, čís. 31, s. 624–5. Dostupné online. DOI:10.1007/BF01506215.
- ↑ LIPMANN, F. Metabolic Generation and Utilization of Phosphate Bond Energy. Adv. Enzymol., 1941, roč. 1, s. 99–162. ISSN 0196-7398.
- ↑ . Dostupné online.
- ↑ 6,00 6,01 6,02 6,03 6,04 6,05 6,06 6,07 6,08 6,09 6,10 VOET, Donald; VOET, Judith. Biochemie. 1.. vyd. Praha : Victoria Publishing, 1995. ISBN 80-85605-44-9.
- ↑ CHANCE, B.; LEES, H.; POSTGATE, J. R.. The meaning of "reversed electron flow" and "high energy electron" in biochemistry. Nature., 1972, roč. 238, čís. 5363, s. 330-1. Dostupné online. ISSN 0028-0836.
- ↑ MILNE, George W. A.. Gardner's commercially important chemicals: synonyms, trade names, and properties. [s.l.] : John Wiley and Sons, 2005. Dostupné online. ISBN 9780471735182. S. 1178.
- ↑ MORAN, Lawrence A.. Sandwalk: Why Is ATP an Important Energy Currency in Biochemistry? [online]. . Dostupné online.
- ↑ 10,0 10,1 VODRÁŽKA, Zdeněk; RAUSCH, Pavel; KÁŠ, Jan. Enzymologie. [s.l.] : VŠCHT v Praze, 1998.
- ↑ ATAULLAKHANOV, Fazoil I.; VITVITSKY, Victor M.. What Determines the Intracellular ATP Concentration. Bioscience Reports, 2002-12-01, roč. 22, čís. 5, s. 501-511. ISSN 0144-8463.
- ↑ BEIS, I.; NEWSHOLME, E. A.. The contents of adenine nucleotides, phosphagens and some glycolytic intermediates in resting muscles from vertebrates and invertebrates. Biochem J., 1975, roč. 152, čís. 1, s. 23-32. Dostupné online. ISSN 0264-6021.
- ↑ EKOKOSKI, Elina. Extracellular ATP as a Regulator of Intracellular Signaling in Thyroid FRTL-5 Cells. Helsinki : [s.n.], 2000. Dostupné online. ISBN 952-91-2781-2.
- ↑ DICARLO, Stephen E.; COLLINS, Heidi L.. Estimating ATP resynthesis during a marathon run: a method to introduce metabolism. Advances in Physiology Education, 2001-06-01, roč. 25, čís. 2, s. 70-71. Dostupné online.
- ↑ MURRAY, Robert K., Daryl K. Granner, Peter A. Mayes, Victor W. Rodwell Harper's Illustrated Biochemistry. [s.l.] : Lange Medical Books/McGraw-Hill; Medical Publishing Division, 2003. ISBN 0-07-138901-6.
|
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |