Multimediaexpo.cz je již 18 let na českém internetu !!
Molybden
Z Multimediaexpo.cz
(+ Vylepšení) |
m (1 revizi) |
Aktuální verze z 25. 7. 2013, 14:26
| Molybden | |
| |
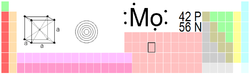
| Atomové číslo | 42 |
| Relativní atomová hmotnost | 95,94 amu |
| Registrační číslo CAS | 7439-98-7 |
| Elektronová konfigurace | [Kr] 4d5 5s1 |
| Elektronegativita (Pauling) | 1,8 |
| Teplota tání | 2623 °C (2896 K) |
| Teplota varu | 4639 °C (4912 K) |
| Hustota | 10,28 g.cm-3 |
| Hustota při teplotě tání | 9,33 g.cm-3 |
Molybden, chemická značka Mo, (lat. molybdaenum), je kovový prvek 6. skupiny periodické soustavy prvků. Praktické využití nalézá hlavně jako složka vysoce legovaných ocelí a při výrobě průmyslových katalyzátorů.
Obsah |
Základní fyzikálně-chemické vlastnosti
Elementární molybden je to stříbřitý až šedobílý, tvrdý a křehký kov se značně vysokým bodem tání. Krystaluje v tělesně centrované kubické mřížce. Na vzduchu je za normální teploty stálý, stejně tak je odolný i vůči působení vody. S vodíkem nereaguje a nevytváří žádné hydridy. Vůči působení minerálních kyselin je poměrně stálý, především oxidačně působící kyseliny pasivují jeho povrch a chrání jej tak před dalším napadením. Stejně tak je odolný vůči roztokům alkalických hydroxidů.
Poměrně snadno se rozpouští v kyselině chlorovodíkové i lučavce královské. Nejsnáze se kovový molybden rozkládá alkalickým tavením napřiklad se směsí dusičnanu draselného a hydroxidu sodného (KNO3 + NaOH). Po zahřátí reaguje s mnoha nekovy za vzniku převážně intersticiálních sloučenin. Ve sloučeninách se molybden vyskytuje v řadě různých mocenství od Mo+2 a po Mo+6 a v rozsáhlé škále různých barev.
Historie
Roku 1778 švédský chemik C. W. Scheele vyizoloval z minerálu molybdenitu oxid dosud neznámého prvku. P. J. Hjelm připravil z tohoto oxidu kovový molybden redukcí dřevěným uhlím. Název molybden pochází z řeckého pojmenování olova molybdos, které označovalo jakýkoliv měkký černý materiál vhodný ke psaní.
Výskyt a výroba
Molybden je na Zemi poměrně vzácný, jeho obsah se odhaduje na 1,5 - 8 mg/kg v zemské kůře. V mořské vodě se však molybden nachází v koncentraci až 0,01 mg/l. Ve vesmíru připadá jeden atom molybdenu na 10 miliard atomů vodíku.
V rudách se vyskytuje jen v nízkých koncentracích. Nejvýznamnější rudou je molybdenit (sulfid molybdeničitý, MoS2), jehož ložiska se nacházejí především v Coloradu v USA. Dalšími rudami jsou wulfenit, molybdenan olovnatý, (PbMoO4) a powellit (Ca(Mo,W)O4). Molybdenit jako MoS2 se těží buď samostaný nebo se získává při výrobě mědi. Po přečištění flotací se pražením převede na oxid molybdenový podle rovnice:
- 2 MoS2 + 7 O2 → 2 MoO3 + 4 SO2
Ten se buď využívá přímo, nebo se aluminotermicky převede na ferromolybden, který nachází použití při výrobě korozivzdorných ocelí.
Čistý molybden se vyrábí redukcí oxidu molybdenu vodíkem.
- MoO3 + 3 H2 → Mo + 3 H2O
Ionty molybdenu jsou také obsaženy v proteinovém komplexu nitrogenáza, který je využíván mutualistickými fixátory (zpravidla gramnegativní bakterie, mikrosymbionti - zejména Rhizobium) atmosferického molekulárního dusíku, přičemž dochází k obohacování půdy.
Využití
Základní praktické využití nalézá molybden v metalurgii při výrobě speciálních ocelí. Již poměrně malé množství molybdenu ve slitině výrazně zvyšuje její tvrdost, mechanickou a korozní odolnost. Proto se z molybdenových ocelí vyrábějí silně mechanicky namáhané součásti strojů jako například hlavně děl, geologické vrtné hlavice a nástroje pro kovoobrábění. Také se z molybdenu dělá povrchová vrstva pístních kroužků V chemickém průmyslu je materiálem pro reaktory, pracující v silně korozivním prostředí za vysokých tlaků a teplot.
Používá se pro výrobu petrochemických katalyzátorů, sloužících k odstranění sirných sloučenin z ropy a ropných produktů.
Sloučeniny
Chemie sloučenin molybdenu je značně pestrá a komplikovaná. Již pouhý fakt, že se molybden vyskytuje v 5 různých valenčních stavech od od Mo+2 a po Mo+6, které mohou poměrně snadno přecházet mezi sebou je důvodem, že chemie molybdenu je spíše předmětem diplomových prací než praktického uplatnění v běžném životě. Většina chemiků se jistě setkala s faktem, že mnohé z bohatého spektra jeho sloučenin vykazují nízkou rozpustnost, což v praxi znamená, že je poměrně velmi obtížné udržet rozpuštěný molybden kompletně v roztoku po delší dobu. Analýza obsahu molybdenu v roztoku se pak někdy stává soutěží s časem, kdy je nutno provést příslušnou operaci dříve, než z roztoku vypadne nějaká pestře zbarvená nerozpustná sloučenina molybdenu. Pro molybden je navíc typická tvorba tzv. heteropolykyselin, polymerních sloučenin molybdenu, kyslíku a vodíku bez přesného stechiometrického vzorce.
V praxi má technologický význam například sulfid molybdeničitý, MoS2 - černá práškovitá sloučenina, která se používá jako lubrikant (mazadlo) v prostředích s vysokou teplotou nebo s extrémním tlakovým namáháním. Dále se můžeme prakticky setkat se solemi kyseliny molybdenové H2MoO4 - molybdenany, které jsou složkou některých barevných pigmentů a nalézají uplatnění v analytické chemii.
Biologický význam
Přestože je molybden přítomen v živých tkáních živočichů a rostlin pouze ve stopovém množství, je nezbytný pro správné fungování běžných životních funkcí. Bylo prokázáno, že se aktivně účastní v řadě enzymatických systémů, které jsou zodpovědné za metabolismus železa a detoxikaci sulfidů. Významnou roli hraje molybden i prevenci zubního kazu a jeho přítomnost zvyšuje tvrdost zubní skloviny. Nedostatek molybdenu může vést k anémii, přispívá k zvýšenému výskytu záchvatů astmatu, zvýšené kazivosti zubů a zhoršení ochrany proti infekci močového měchýře. Podle některých zdrojů je nedostatek molybdenu ve stravě příčinou depresivních stavů a může vést k impotenci.
Hlavním přirozeným zdrojem molybdenu v potravě jsou luštěniny, celozrnné pečivo a listová zelenina.
Literatura
- Cotton F.A., Wilkinson J.:Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973
- Holzbecher Z.:Analytická chemie, SNTL, Praha 1974
- Dr. Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- N. N. Greenwood - A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993 ISBN 80-85427-38-9
Externí odkazy
- Periodická soustava a tabulka vlastností prvků [1]
- Chemický vzdělávací portál [2]
- WebElements (anglicky) [3]
- Periodická tabulka prvků [4]
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |


