Multimediaexpo.cz je již 18 let na českém internetu !!
Chloroform
Z Multimediaexpo.cz
m (1 revizi) |
m (1 revizi) |
| (Není zobrazena jedna mezilehlá verze.) | |
Aktuální verze z 26. 4. 2014, 11:10
Chloroform neboli trichlormethan (mimo chemii dle PČP trichlormetan), je bezbarvá těkavá, avšak nehořlavá kapalina charakteristického nasládlého zápachu. Jeho páry jsou značně těžší než vzduch (4,12 krát), proto se v uzavřených prostorách hromadí u podlahy a obtížně se vyvětrává.
Obsah |
Příprava
Původně byl chloroform připraven Liebenovou reakcí (nazývaná též haloformní reakce), tj. působením chlornanu vápenatého (chlorového vápna) na ethanol
- 2 CH3CH2OH + 8 Ca(ClO)2 → 2 CHCl3 + (HCOO)2Ca + 5 CaCl2 + 2 H2O + 2 Ca(OH)2;
při reakci vznikají jako vedlejší produkty mravenčan vápenatý, chlorid vápenatý, hydroxid vápenatý a voda. Podobně lze připravit chloroform též působením chlornanu vápenatého na acetaldehyd nebo aceton. Při přípravě může být místo chlornanu vápenatého použit též chlornan sodný.
Průmyslově se chloroform vyrábí zahříváním směsi chloru s chlormethanem nebo methanem na teplotu 400–500 °C. Při této teplotě se nejprve uvolní radikál chlóru (podrobnosti viz příprava tetrachlormethanu) a postupně nahradí v methanu nebo chlormethanu vodíkové atomy, čímž vznikne směs čtyř chlorovaných uhlovodíků (chlormethan, dichlormethan, trichlormethan (chloroform) a tetrachlormethan)
- CH4 + Cl2 → CH3Cl + HCl,
- CH3Cl + Cl2 → CH2Cl2 + HCl,
- CH2Cl2 + Cl2 → CHCl3 + HCl,
- CHCl3 + Cl2 → CCl4 + HCl.
Vzniklá směs se pak rozdělí destilací na jednotlivé čisté sloučeniny.
Vlastnosti
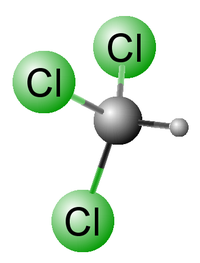
Molekula chloroformu má jednu trojčetnou osu symetrie a tři roviny symetrie (bodová grupa symetrie C3v). Protože nemá střed symetrie je vzhledem ke značné polaritě vazeb C—Cl celá molekula polární (dipólový moment 1,08 D). Díky tomu je chloroform velmi dobrým rozpouštědlem zejména tuků. Kromě toho polarita vazeb C—Cl způsobuje, že vodíkový atom molekuly chloroformu je značně reaktivní.
Vzhledem k tomu se tento vodík snadno atakuje oxidačními činidly, a to i pouhým vzdušným kyslíkem (zejména za současného působení světla), přičemž vzniká jedovatý fosgen; jako meziprodukt se vytváří nestabilní trichlormethanol
- 2 CHCl3 → [Cl3COH] → HCl + COCl2.
Působením silných hydroxidů, např. roztoku hydroxidu sodného se odštěpují z molekuly chloroformu atomy chloru a vzniká kyselina mravenčí, která se okamžitě neutralizuje na mravenčan sodný
- CHCl3 + 4 NaOH → 2 H2O + 3 NaCl + HCOONa.
Současným působením hydroxidu draselného a amoniaku vzniká kyanid draselný, chlorid draselný a voda
- CHCl3 + NH3 + 4 KOH → 3 KCl + 4 H2O + KCN.
V zásaditém prostředí reaguje chloroform s aldehydy a ketony za vzniku sekundárních resp. terciárních alkoholů s koncovou trichlormethylovou skupinou, např s acetonem vytváří 1,1,1-trichlor-2-methyl-propan-2-ol
CH3COCH3 + CHCl3 → (CH3)2C(OH)CCl3.
Působením fluoridů těžkých kovů, zejména fluoridu stříbrného nebo fluoridu antimonitého dochází k částečné nebo úplné výměně atomů chloru atomy fluoru, např.
- CHCl3 + SbF3 → CHF3 + SbCl3.
Působením chloroformu na fenoly za přítomnosti silných anorganických hydroxidů, např. hydroxidu draselného, vznikají aromatické hydroxyaldehydy, přičemž se aldahydická skupiny –CHO vnáší především do orto polohy vůči fenolickému hydroxylu; v menší míře vznikají i para deriváty. Tato reakce, známá od roku 1876, je podle svých objevitelů nazývána Reimerova-Tiemannova syntéza. Tak např. z fenolu vzniká směs o-hydroxybenzaldehydu (salicylaldehydu) a p-hydroxybenzaldehydu
Použití
Koncem 19. a v 20. století byl chloroform používán při operacích jako inhalační anestetikum, které dočasně nahradilo méně příjemný, avšak zdravotně bezpečnější diethylether. Po zjištění nežádoucích účinků chloroformu byl tento postupně opuštěn, nahrazen opět nejdříve diethyletherem a později jinými bezpečnějšími přípravky.
Dnes je používán v chemickém průmyslu hlavně při výrobě chladicího media pro ledničky a klimatizace, freonu R-22 (chlordifluormethan, CHClF2); jeho využívání k tomuto účelu se však bude stále snižovat v souvislosti s omezováním používání freonů podle ustanovení Montrealského protokolu. Je také surovinou pro výrobu řady dalších organických sloučenin, např. aromatických aldehydů.
Chloroform se též používá jako rozpouštědlo v chemické laboratoři, ve farmaceutickém průmyslu a při výrobě pesticidů a nátěrových hmot. Je výborným lepidlem některých plastů, např. polystyrenu nebo plexiskla.
Deuterochloroform, derivát chloroformu, u kterého byl vodíkový atom nahrazen atomem deuteria (těžkým vodíkem), CDCl3, je nejpoužívanějším rozpouštědlem v NMR spektroskopii.
V roce 1973 činila světová produkce chloroformu cca 2,5 milionu tun ročně[1].
Fyziologické působení
Do těla může chloroform pronikat všemi cestami - vdechováním, požitím nebo vstřebáním přes kůži, případně oči. Dráždí pokožku a sliznice, v očích může způsobit nekrózu a vznik vředů. Po vstřebání se šíří do celého těla, koncentruje se zejména v tukových tkáních, odkud se pak může uvolňovat ještě řadu hodin.[1]
Při vdechování par chloroformu se vstřebá 64-67 %. Při anestetických koncentracích (8000-10000 ppm) během několika minut dosáhne koncentrace v krvi hodnot okolo 100 mg/l.[1]
Zhruba 60-70 % chloroformu se z těla vylučuje v nezměněné podobě prostřednictvím vydechovaného vzduchu, zbývajících 30-40 % odchází ve formě metabolitů močí a stolicí. Podíl metabolizace chloroformu závisí na celkové dávce, je vyšší při nižších dávkách.[1]
Inhalace par chloroformu vede ke tlumení centrálního nervového systému. Vdechování vzduchu obsahujícího 900 ppm po krátkou dobu způsobuje závratě, ospalost a bolesti hlavy. Vysoké dávky způsobují hluboké kóma a útlum dechového centra, který může vést k smrti.[1]
Vysoké dávky mohou způsobit také srdeční arytmii až fibrilaci komor, a to přímým účinkem na myokard, stimulací vagu nebo senzibilizací na katecholaminy. Fibrilace může být smrtelná. Chloroform také snižuje krevní tlak oslabením srdeční kontrakce a periferní vazodilatací (opět následkem stimulace vagu).[1]
Nejnižší smrtelná dávka LDLo pozorovaná u člověka při požití byla 2514 mg/kg. U krys byla experimentálně stanovena hodnota LD50 při podání v potravě 695 mg/kg, resp. 894 mg/kg při intraperitoneální aplikací (injekcí do břišní dutiny).[zdroj ?]
Chloroform je toxický pro játra a ledviny - jsou za ni odpovědné zřejmě metabolity chloroformu, zejména fosgen, karben a chlor, které se váží na makromolekuly jaterních a ledvinových buněk. Toxicita je ovlivněna látkami působícími na jaterní enzymy. Barbituráty, DDT, ethanol apod. zvyšují míru poškození jater a ledvin.[1]
Chloroform je prokázaný karcinogen pro myši a potkany. Dlouhodobé požívání velmi malých dávek (0,75 a 75 ppm) v pitné vodě se ukázalo jako dostatečné, aby prokazatelně podpořilo růst a šíření nádorů. Ohledně působení na člověka nejsou dostatečné důkazy pro prokázání karcinogenity, nicméně se chloroform považuje za potenciální karcinogen.[1]
Chloroform je prokazatelně teratogenní pro myši, potkany a králíky. Mutagenita nebyla prokázána. Ohledně vlivů tohoto druhu na člověka není k dispozici dostatek informací.[1]
Historie

Chloroform objevil v červenci 1831 americký lékař Samuel Guthrie (1782-1848) a nezávisle na něm, několik měsíců později, francouzský chemik Eugène Soubeiran (1797-1859) a v Německu Justus von Liebig (1803-1873). Soubeiran připravil chloroform již zmiňovanou Liebenovou reakcí z ethanolu případně acetonu. Chloroform pojmenoval a odvodil jeho chemické složení o tři roky později (1834) Jean-Baptiste Dumas (1800-1884). Jeho narkotické účinky poprvé pozorovali v roce 1847 francouzský fyziolog Marie-Jean-Pierre Flourens (1794-1867) a Robert James Fegle (1790-1842).
V roce 1847 v Edinburghu tamější porodník James Young Simpson jako první použil chloroformu k celkové anestezi při porodu. Následně se jeho používání při chirurgických zákrocích rychle rozšířilo po celé Evropě. První anesteziolog z povolání John Snow se proslavil podáním chloroformu britské královně Viktorii v roce 1853 k porodu prince Leopolda (pozdější vévoda z Albany).
V USA však jeho užívání místo diethyletheru se ujalo teprve na počátku 20. stol., ale po zjištění, že může způsobit srdeční selhání, byl zde rychle opuštěn. Jako jeho náhrada byl zkoušen také trichlorethen (trichlorethylen), ale i ten byl po zjištění jeho karcinogenicity odmítnut.
Ekologie
Jako většina halogenovaných uhlovodíků patří i chloroform mezi látky potenciálně ohrožující ozónovou vrstvu. Vzhledem k jeho vysoké specifické hmotnosti v plynném skupenství je však méně nebezpečný než freony, které se snadněji dostávají do vysokých vrstev atmosféry.
Vzhledem k vysoké toxicitě pro vodní organismy je nebezpečnou látkou z hlediska znečištění vodních toků odpadními vodami z podniků, které chloroform používají.
Vzniká také v menších množstvích z některých organických látek (alkoholy, ketony, aldehydy) při dezinfekci pitné vody chlorováním, což může vést k chronickým zdravotním potížím při jejím dlouhodobém používání k přípravě pokrmů a nápojů.
Chloroform v kultuře
Chloroformem napuštěný kapesník je tradičním nástrojem určeným k omámení oběti ve filmech 80. let jako Knight Rider nebo King Kong. Zlosyn obvykle kápne několik kapek chloroformu z malé lahvičky na kapesník, přikrade se za oběť a po krátkém zápase oběť upadá do bezvědomí. Ve skutečnosti je potřebná dávka větší a příliš se neliší od dávky smrtelné.
Související články
Reference
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 Chloroform - International Programme on Chemical Safety - Poisons Information Monograph 121
Externí odkazy
- Concise International Chemical Assessment Document 58
- History of chloroform anesthesia
- IARC Monograph on Chloroform
- International Chemical Safety Card 0027
- National Pollutant Inventory - Chloroform and trichloromethane
- NIOSH Pocket Guide to Chemical Hazards
- NIST Standard Reference Database
- Story on Chloroform from BBC's The Material World (28 July 2005)
- Sudden Sniffer's Death Syndrome article at Carolina Poison Center
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |