Přejeme Vám krásné svátky a 52 týdnů pohody a štěstí v roce 2025 !
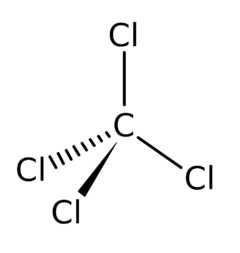
Tetrachlormethan
Z Multimediaexpo.cz
m (1 revizi) |
(++) |
||
| Řádka 1: | Řádka 1: | ||
{{Infobox Chemická sloučenina | {{Infobox Chemická sloučenina | ||
|Název=Tetrachlormethan | |Název=Tetrachlormethan | ||
| - | |Obrázek= | + | |Obrázek= |
|Systematický název=tetrachlormethan (organické názvosloví)<br />chlorid uhličitý (anorganické názvosloví) | |Systematický název=tetrachlormethan (organické názvosloví)<br />chlorid uhličitý (anorganické názvosloví) | ||
|Triviální název=tetrachlór | |Triviální název=tetrachlór | ||
| Řádka 40: | Řádka 40: | ||
|Reaktivita=0 | |Reaktivita=0 | ||
|Ostatní rizika=}} | |Ostatní rizika=}} | ||
| - | }} | + | }}[[Soubor:Carbon Tetrachloride.png|thumb|240px|Strukturní vzorec]] |
'''Tetrachlormethan''' neboli '''chlorid uhličitý''', v technické hantýrce někdy označovaný '''tetrachlór''', je bezbarvá [[kapalina]] sladkého éterického zápachu, prakticky [[rozpustnost|nerozpustná]] ve [[voda|vodě]], zato dobře rozpustná v řadě organických rozpouštědel jako je [[methanol]], [[ethanol]], [[aceton]], [[benzen]], [[Benzín|benzin]] aj. | '''Tetrachlormethan''' neboli '''chlorid uhličitý''', v technické hantýrce někdy označovaný '''tetrachlór''', je bezbarvá [[kapalina]] sladkého éterického zápachu, prakticky [[rozpustnost|nerozpustná]] ve [[voda|vodě]], zato dobře rozpustná v řadě organických rozpouštědel jako je [[methanol]], [[ethanol]], [[aceton]], [[benzen]], [[Benzín|benzin]] aj. | ||
== Příprava == | == Příprava == | ||
| - | |||
Tetrachlormethan se dá připravit přímou [[chloraxe|chlorací]] [[methan]]u působením [[chlor]]u za zvýšené teploty nebo lépe za působení [[ultrafialové záření|ultrafialového záření]] podle souhrnné rovnice | Tetrachlormethan se dá připravit přímou [[chloraxe|chlorací]] [[methan]]u působením [[chlor]]u za zvýšené teploty nebo lépe za působení [[ultrafialové záření|ultrafialového záření]] podle souhrnné rovnice | ||
| Řádka 86: | Řádka 85: | ||
:CS<sub>2</sub> + 3 Cl<sub>2</sub> → CCl<sub>4</sub> + S<sub>2</sub>Cl<sub>2</sub>. | :CS<sub>2</sub> + 3 Cl<sub>2</sub> → CCl<sub>4</sub> + S<sub>2</sub>Cl<sub>2</sub>. | ||
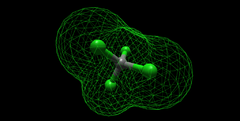
| + | [[Soubor:Tetrachlormethan-2006.png|thumb|240px|Molekulární geometrie]] | ||
== Vlastnosti == | == Vlastnosti == | ||
| - | + | Vzhledem k vysoké [[tetraedr]]ické symetrii molekuly tetrachlormethanu ([[bodová grupa symetrie]] ''T''<sub>d</sub>) nemá dipólový moment (je nepolární), přestože jednotlivé vazby C—Cl jsou značně polární. V důsledku toho je tetrachlormethan nerozpustný ve vodě, ale velice dobře naopak rozpouští jiné nepolární nebo málo polární látky, především tuky, oleje, pryskyřice atp. Chemicky je vcelku málo reaktivní, s kyslíkem prakticky nereaguje, je proto nehořlavý. Za vysokých teplot však s [[kyslík]]em reaguje za vzniku [[fosgen]]u a chloru | |
| - | Vzhledem k vysoké [[tetraedr]]ické symetrii molekuly tetrachlormethanu ([[bodová grupa symetrie]] ''T''<sub>d</sub>) nemá dipólový moment (je nepolární), přestože jednotlivé vazby C—Cl jsou značně polární. V důsledku toho je tetrachlormethan nerozpustný ve vodě, ale velice dobře naopak rozpouští jiné nepolární nebo málo polární látky, především tuky, oleje, pryskyřice atp. Chemicky je vcelku málo reaktivní, s kyslíkem prakticky nereaguje, je proto nehořlavý. Za vysokých teplot však s [[kyslík]]em reaguje za vzniku [[fosgen]]u a chloru | + | |
:2 CCl<sub>4</sub> + O<sub>2</sub> → 2 COCl<sub>2</sub> + 2 Cl<sub>2</sub>. | :2 CCl<sub>4</sub> + O<sub>2</sub> → 2 COCl<sub>2</sub> + 2 Cl<sub>2</sub>. | ||
| Řádka 100: | Řádka 99: | ||
:3 CCl<sub>4</sub> + 4 AlI<sub>3</sub> → 6 CI<sub>2</sub> + 4 AlCl<sub>3</sub>. | :3 CCl<sub>4</sub> + 4 AlI<sub>3</sub> → 6 CI<sub>2</sub> + 4 AlCl<sub>3</sub>. | ||
| + | [[Soubor:Carbon tetrachloride 1930s fire extinguisher.jpg|thumb|240px|Tetrachlorový hasicí přístroj<br />ze 30. let 20. století]] | ||
== Použití == | == Použití == | ||
| - | |||
Používá se jako [[rozpouštědlo]] v chemické laboratoři. Slouží také k přípravě alkylchloridů Apellovou reakcí z příslušných [[alkoholy|alkoholů]] za přítomnosti [[trifenylfosfan]]u. | Používá se jako [[rozpouštědlo]] v chemické laboratoři. Slouží také k přípravě alkylchloridů Apellovou reakcí z příslušných [[alkoholy|alkoholů]] za přítomnosti [[trifenylfosfan]]u. | ||
| - | V minulosti se používal jako chladicí médium v chladicích systémech, při chemickém čištění látek a oděvů, k průmyslovému odmašťování předmětů, jako ředidlo v nátěrových hmotách, jako součást hnací látky v aerosolových bombičkách (zejména s nátěrovými hmotami) a také jako náplň [[hasicí přístroj|hasicích přístrojů]] (tzv. ''tetrachlorové hasicí přístroje''). Krátkou dobu se užíval i jako insekticidní prostředek proti škůdcům napadajícím zrní (obiloviny). V souvislosti s jeho zdraví škodlivými vlivy se jeho užití omezuje, v některých zemích (např. v [[Spojené státy americké|USA]]) je jeho používání ve spotřebním zboží zakázáno. | + | V minulosti se používal jako chladicí médium v chladicích systémech, při chemickém čištění látek a oděvů, k průmyslovému odmašťování předmětů, jako ředidlo v nátěrových hmotách, jako součást hnací látky v aerosolových bombičkách (zejména s nátěrovými hmotami) a také jako náplň [[hasicí přístroj|hasicích přístrojů]] (tzv. ''tetrachlorové hasicí přístroje''). Krátkou dobu se užíval i jako insekticidní prostředek proti škůdcům napadajícím zrní (obiloviny). V souvislosti s jeho zdraví škodlivými vlivy se jeho užití omezuje, v některých zemích (např. v [[Spojené státy americké|USA]]) je jeho používání ve spotřebním zboží zakázáno. |
Dalším důvodem pro útlum jeho výroby a používání je stejný vliv na [[ozónová vrstva|ozónovou vrstvu]] jako mají [[freony]]. | Dalším důvodem pro útlum jeho výroby a používání je stejný vliv na [[ozónová vrstva|ozónovou vrstvu]] jako mají [[freony]]. | ||
| Řádka 114: | Řádka 113: | ||
== Externí odkazy == | == Externí odkazy == | ||
| - | * (anglicky) [http://monographs.iarc.fr/ENG/Monographs/vol71/volume71.pdf Carbon Tetrachloride] | + | * (anglicky) [http://monographs.iarc.fr/ENG/Monographs/vol71/volume71.pdf IARC Monograph – Carbon Tetrachloride] |
* (anglicky) [http://www.atsdr.cdc.gov/toxprofiles/tp30.pdf Toxikologický profil] na atsdr.cdc.gov | * (anglicky) [http://www.atsdr.cdc.gov/toxprofiles/tp30.pdf Toxikologický profil] na atsdr.cdc.gov | ||
* (anglicky) [http://ntp.niehs.nih.gov/ntp/roc/eleventh/profiles/s029carb.pdf Toxikologický profil] na US NPT | * (anglicky) [http://ntp.niehs.nih.gov/ntp/roc/eleventh/profiles/s029carb.pdf Toxikologický profil] na US NPT | ||
Aktuální verze z 5. 10. 2022, 11:21
Tetrachlormethan neboli chlorid uhličitý, v technické hantýrce někdy označovaný tetrachlór, je bezbarvá kapalina sladkého éterického zápachu, prakticky nerozpustná ve vodě, zato dobře rozpustná v řadě organických rozpouštědel jako je methanol, ethanol, aceton, benzen, benzin aj.
Obsah |
Příprava
Tetrachlormethan se dá připravit přímou chlorací methanu působením chloru za zvýšené teploty nebo lépe za působení ultrafialového záření podle souhrnné rovnice
- CH4 + 4 Cl2 → CCl4 + 4 HCl.
Tato reakce probíhá řetězově a ve čtyřech stupních, přičemž spouštěcím stupněm je tepelná disociace nebo fotodisociace molekulárního chloru Cl2 na dva chloridové radikály
- Cl2 + hν → 2 Cl·;
vzniklý vysoce reaktivní atomární chlor vytrhne z molekuly methanu vodík, se kterým vytvoří molekulu chlorovodíku a zanechá methylový radiál
- Cl· + CH4 → ·CH3 + HCl.
Methylový radikál atakuje další molekulu chloru za vzniku monochlormethanu a dalšího chloridového radikálu
- ·CH3 + Cl2 → CH3Cl + Cl·.
Řetězová reakce pak probíhá postupně dále
- CH3Cl + Cl· → ·CH2Cl + HCl,
- ·CH2Cl + Cl2 → CH2Cl2 + Cl·,
- CH2Cl2 + Cl· → ·CHCl2 + HCl,
- ·CHCl2 + Cl2 → CHCl3 + Cl·,
- CHCl3 + Cl· → ·CCl3 + HCl,
- ·CCl3 + Cl2 → CCl4 + Cl·.
Řetězová reakce může být ukončena tím, že se náhodně setkají a sloučí dva stejné nebo různé radikály, např.
- Cl· + ·Cl → Cl2,
- H3C· + ·CH3 → H3C—CH3,
- H3C· + ·Cl → CH3Cl,
ale také např.
- H3C· + ·CH2Cl → H3C—CH2Cl,
takže i když se chloruje čistý methan, mohou vznikat v reakční směsi také stopy chlorovaných vyšších uhlovodíků. Proto se touto reakcí získává pouze jako vedlejší produkt při výrobě dichlormethanu a trichlormethanu (chloroformu).
Průmyslově se tetrachlormethan vyrábí většinou ze sirouhlíku a chloru
- CS2 + 3 Cl2 → CCl4 + S2Cl2.
Vlastnosti
Vzhledem k vysoké tetraedrické symetrii molekuly tetrachlormethanu (bodová grupa symetrie Td) nemá dipólový moment (je nepolární), přestože jednotlivé vazby C—Cl jsou značně polární. V důsledku toho je tetrachlormethan nerozpustný ve vodě, ale velice dobře naopak rozpouští jiné nepolární nebo málo polární látky, především tuky, oleje, pryskyřice atp. Chemicky je vcelku málo reaktivní, s kyslíkem prakticky nereaguje, je proto nehořlavý. Za vysokých teplot však s kyslíkem reaguje za vzniku fosgenu a chloru
- 2 CCl4 + O2 → 2 COCl2 + 2 Cl2.
S některými anorganickými bromidy a jodidy, zejména hlinitými, reaguje tak, že v jeho molekule dojde k výměně chloru za těžší halogenidy, např.
- 3 CCl4 + 4 AlBr3 → 3 CBr4 + 4 AlCl3,
resp.
- 3 CCl4 + 4 AlI3 → 6 CI2 + 4 AlCl3.
Použití
Používá se jako rozpouštědlo v chemické laboratoři. Slouží také k přípravě alkylchloridů Apellovou reakcí z příslušných alkoholů za přítomnosti trifenylfosfanu.
V minulosti se používal jako chladicí médium v chladicích systémech, při chemickém čištění látek a oděvů, k průmyslovému odmašťování předmětů, jako ředidlo v nátěrových hmotách, jako součást hnací látky v aerosolových bombičkách (zejména s nátěrovými hmotami) a také jako náplň hasicích přístrojů (tzv. tetrachlorové hasicí přístroje). Krátkou dobu se užíval i jako insekticidní prostředek proti škůdcům napadajícím zrní (obiloviny). V souvislosti s jeho zdraví škodlivými vlivy se jeho užití omezuje, v některých zemích (např. v USA) je jeho používání ve spotřebním zboží zakázáno.
Dalším důvodem pro útlum jeho výroby a používání je stejný vliv na ozónovou vrstvu jako mají freony.
Účinky na zdraví
Nadýchání par tetrachlomethanu ovlivňuje zejména centrální nervový systém člověka. Způsobuje bolesti hlavy, halucinace, ospalost, žaludeční nevolnost a ve větším množství může způsobit i zvracení. Při vysokých koncentracích může způsobit i smrt. Dlouhodobé působení může způsobit chronické poruchy jater a ledvin. Škodlivé účinky se zvyšují při současném požití alkoholu. Do těla se může vstřebávat i pokožkou. Při zasažení očí způsobuje jejich podráždění.
U laboratorních zvířat (potkanů) byla prokázána jeho karcinogenicita, tzn. že může vyvolat rakovinné bujení, a proto je IARC řazena do skupiny 2B.
Externí odkazy
- (anglicky) IARC Monograph – Carbon Tetrachloride
- (anglicky) Toxikologický profil na atsdr.cdc.gov
- (anglicky) Toxikologický profil na US NPT
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |