Naše návštěvnost dne 25. února 2026 byla — 484 927 unikátních návštěvníků !!
Kobalt
Z Multimediaexpo.cz
(+ Vylepšení) |
(→Výroba: Arsenidy) |
||
| (Nejsou zobrazeny 4 mezilehlé verze.) | |||
| Řádka 1: | Řádka 1: | ||
| - | {|border="1" cellpadding="2" cellspacing="1" width=" | + | {|border="1" cellpadding="2" cellspacing="1" width="366" align="right" style="margin:0 0 .5em 1em; border-collapse:collapse;" |
| colspan="2" align="center" bgcolor="fefe00"| <font size=+1>'''Kobalt'''</font> | | colspan="2" align="center" bgcolor="fefe00"| <font size=+1>'''Kobalt'''</font> | ||
|- | |- | ||
| Řádka 18: | Řádka 18: | ||
|[[Teplota varu]]||3 100 °C, (3 473 K) | |[[Teplota varu]]||3 100 °C, (3 473 K) | ||
|- | |- | ||
| - | |Vzhled||[[Soubor: | + | |Vzhled||[[Soubor:Kobalt electrolytic and 1cm3 cube.jpg|200px|Plátky kobaltu]] |
|- | |- | ||
|[[Elektronegativita]] (Pauling)|| 1,88 | |[[Elektronegativita]] (Pauling)|| 1,88 | ||
| Řádka 32: | Řádka 32: | ||
|[[Registrační číslo CAS]]||7440-48-4 | |[[Registrační číslo CAS]]||7440-48-4 | ||
|- | |- | ||
| - | |[[Specifické teplo]] || 0,0928 kJ/mol | + | |[[Měrná tepelná kapacita|Specifické teplo]] || 0,0928 kJ/mol |
|- | |- | ||
|[[Atomový poloměr]] || 1,25 Å | |[[Atomový poloměr]] || 1,25 Å | ||
| Řádka 49: | Řádka 49: | ||
|- | |- | ||
|[[Elektrický odpor]] při 20 °C || 6,24 μΩ | |[[Elektrický odpor]] při 20 °C || 6,24 μΩ | ||
| - | |} | + | |}'''Kobalt''', chemická značka '''Co''', (lat.'' Cobaltum'') je namodralý, [[Feromagnetismus|feromagnetický]], tvrdý [[kov]]. Používá se v [[metalurgie|metalurgii]] pro zlepšování vlastností slitin při barvení skla a keramiky a je důležitý i biologicky. |
| - | '''Kobalt''', chemická značka '''Co''', (lat.'' Cobaltum'') je namodralý, [[Feromagnetismus|feromagnetický]], tvrdý [[kov]]. Používá se v [[metalurgie|metalurgii]] pro zlepšování vlastností slitin při barvení skla a keramiky a je důležitý i biologicky. | + | |
== Základní fyzikálně - chemické vlastnosti == | == Základní fyzikálně - chemické vlastnosti == | ||
Typický '''kovový ferromagnetický prvek''', stříbrolesklý s modrým nádechem. Je velmi pevný, svou [[tvrdost]]í a pevností předčí [[ocel]]. Kobalt je [[feromagnetismus|feromagnetický]] do teploty 1000 °C, nad touto teplotou své feromagnetické vlastnosti ztrácí. Bod při němž [[kov]] ztrácí feromagnetické vlastnosti se nazývá [[Curieův bod]]. Kobalt patří mezi přechodné prvky, které mají valenční elektrony v ''d''-sféře. Ve sloučeninách se vyskytuje především v mocenství Co<sup>+II</sup> a Co<sup>+III</sup>, vzácně se můžeme setkat i s Co<sup>+I</sup>, Co<sup>+IV</sup> a od nedávna také s některými nestabilními sloučeninami v oxidačním stavu Co<sup>+V</sup> například Na<sub>3</sub>Co<sup>V</sup>O<sub>4</sub>. | Typický '''kovový ferromagnetický prvek''', stříbrolesklý s modrým nádechem. Je velmi pevný, svou [[tvrdost]]í a pevností předčí [[ocel]]. Kobalt je [[feromagnetismus|feromagnetický]] do teploty 1000 °C, nad touto teplotou své feromagnetické vlastnosti ztrácí. Bod při němž [[kov]] ztrácí feromagnetické vlastnosti se nazývá [[Curieův bod]]. Kobalt patří mezi přechodné prvky, které mají valenční elektrony v ''d''-sféře. Ve sloučeninách se vyskytuje především v mocenství Co<sup>+II</sup> a Co<sup>+III</sup>, vzácně se můžeme setkat i s Co<sup>+I</sup>, Co<sup>+IV</sup> a od nedávna také s některými nestabilními sloučeninami v oxidačním stavu Co<sup>+V</sup> například Na<sub>3</sub>Co<sup>V</sup>O<sub>4</sub>. | ||
Kobalt se vyskytuje v přírodě ve dvou [[alotropická modifikace|alotropických modifikacích]] označovaných α-Co a β-Co. První je stabilní za obyčejné teploty a kobalt v ní zaujímá těsné uspořádání v hexagonální mřížce. Druhá modifikace je stabilní nad teplotou 417 °C a kobalt v ní zaujímá uspořádání atomů v plošně centrované kubické mřížce. Přeměna mezi modifikacemi je malá, což má vliv na fyzikální vlastnosti kovu. | Kobalt se vyskytuje v přírodě ve dvou [[alotropická modifikace|alotropických modifikacích]] označovaných α-Co a β-Co. První je stabilní za obyčejné teploty a kobalt v ní zaujímá těsné uspořádání v hexagonální mřížce. Druhá modifikace je stabilní nad teplotou 417 °C a kobalt v ní zaujímá uspořádání atomů v plošně centrované kubické mřížce. Přeměna mezi modifikacemi je malá, což má vliv na fyzikální vlastnosti kovu. | ||
| - | V kompaktním stavu je kobalt vůči vzduchu i vodě stabilní. V jemně rozptýleném stavu je kobalt stejně jako [[železo]] pyroforický (je samozápalný na vzduchu). Ve zředěných kyselinách, jako je [[kyselina chlorovodíková]], [[kyselina sírová]] a [[kyselina dusičná]], se rozpouští, ale velmi neochotně a pomalu. V koncentrované [[kyselina dusičná|kyselině dusičné]] se kobalt, stejně jako [[železo]] pouze [[pasivace|pasivuje]]. | + | V kompaktním stavu je kobalt vůči vzduchu i vodě stabilní. V jemně rozptýleném stavu je kobalt stejně jako [[železo]] pyroforický (je samozápalný na vzduchu). Ve zředěných kyselinách, jako je [[kyselina chlorovodíková]], [[kyselina sírová]] a [[kyselina dusičná]], se rozpouští, ale velmi neochotně a pomalu. V koncentrované [[kyselina dusičná|kyselině dusičné]] se kobalt, stejně jako [[železo]] pouze [[pasivace|pasivuje]]. |
Při zahřívání shoří kobalt na [[vzduch]]u na [[oxid kobaltnato-kobaltitý]] Co<sub>3</sub>O<sub>4</sub>. Při zahřívání na vzduchu nad 900 °C shoří kobalt na [[oxid kobaltnatý]] CoO. Ten vzniká i při působení vodní páry na kov zahřátý do červeného žáru. Za normální teploty je kobalt málo reaktivní, ale za vyšších teplot se často za vzniku plamene slučuje s mnoha prvky ([[síra]], [[fosfor]], [[arsen]], [[antimon]], [[cín]], [[zinek]], [[křemík]], [[Bor (prvek)|bor]], [[halogen]]y…). Neslučuje se však s [[dusík]]em a [[vodík]]em. | Při zahřívání shoří kobalt na [[vzduch]]u na [[oxid kobaltnato-kobaltitý]] Co<sub>3</sub>O<sub>4</sub>. Při zahřívání na vzduchu nad 900 °C shoří kobalt na [[oxid kobaltnatý]] CoO. Ten vzniká i při působení vodní páry na kov zahřátý do červeného žáru. Za normální teploty je kobalt málo reaktivní, ale za vyšších teplot se často za vzniku plamene slučuje s mnoha prvky ([[síra]], [[fosfor]], [[arsen]], [[antimon]], [[cín]], [[zinek]], [[křemík]], [[Bor (prvek)|bor]], [[halogen]]y…). Neslučuje se však s [[dusík]]em a [[vodík]]em. | ||
== Historický vývoj == | == Historický vývoj == | ||
O prvním používaní sloučenin kobaltu se dozvídáme z egyptských archeologických nálezů. Ty pochází z doby 2600 př. n. l. a jedná se [[karamika|keramiku]] a skleněné [[perla|perly]], které byly barveny kobaltovou modří do modra. Horníci ve středověku označovali jako ''kobalty'' rudy, které se i přes svůj kovový vzhled nedaly hutnicky zpracovat na [[kov]]. Jméno kobalt má základ v německém pojmenování skřítků ''Koboltů'', kteří byly spíše zlomyslní a kazili horníkům práci. Přítomnost kobaltu totiž zhoršovala kvalitu a zpracovatelnost vytěžených niklových rud a kobaltové příměsi i více ohrožovaly jejich zdraví, protože se při jejich pražení uvolňovaly nebezpečné jedovaté plyny s obsahem As<sub>4</sub>O<sub>6</sub>. Později se toto označení omezilo pouze na rudy, které se daly obtížně hutnicky zpracovat a barvily [[sklo]] na modro. Kov, který byl součástí těchto rud, objevil roku 1735 švédský chemik [[Georg Bradnt]] a nazval jej ''cobalt rex'' a roku 1780 T. O. Bergman ukázal, že jde o nový prvek. | O prvním používaní sloučenin kobaltu se dozvídáme z egyptských archeologických nálezů. Ty pochází z doby 2600 př. n. l. a jedná se [[karamika|keramiku]] a skleněné [[perla|perly]], které byly barveny kobaltovou modří do modra. Horníci ve středověku označovali jako ''kobalty'' rudy, které se i přes svůj kovový vzhled nedaly hutnicky zpracovat na [[kov]]. Jméno kobalt má základ v německém pojmenování skřítků ''Koboltů'', kteří byly spíše zlomyslní a kazili horníkům práci. Přítomnost kobaltu totiž zhoršovala kvalitu a zpracovatelnost vytěžených niklových rud a kobaltové příměsi i více ohrožovaly jejich zdraví, protože se při jejich pražení uvolňovaly nebezpečné jedovaté plyny s obsahem As<sub>4</sub>O<sub>6</sub>. Později se toto označení omezilo pouze na rudy, které se daly obtížně hutnicky zpracovat a barvily [[sklo]] na modro. Kov, který byl součástí těchto rud, objevil roku 1735 švédský chemik [[Georg Bradnt]] a nazval jej ''cobalt rex'' a roku 1780 T. O. Bergman ukázal, že jde o nový prvek. | ||
== Výskyt == | == Výskyt == | ||
| - | [[Soubor:Cobalt OreUSGOV.jpg|thumb| | + | [[Soubor:Cobalt OreUSGOV.jpg|thumb|220px|Ruda kobaltu]] |
Oproti příbuznému [[nikl]]u je zastoupení kobaltu na Zemi i ve vesmíru výrazně nižší. V [[zemská kůra|zemské kůře]] činí průměrný obsah kobaltu kolem 25 mg/kg, čímž se zařazuje na 30. místo ve výskytu prvků na zemi. Jeho procentuální obsah odpovídá 29 ppm (''parts per milion'' = počet částic na 1 milion částic). V mořské [[voda|vodě]] se jeho koncentrace pohybuje na úrovni 0,27 mikrogramu v jednom litru. Předpokládá se, že ve [[vesmír]]u připadá na jeden atom kobaltu přibližně 15 milionů atomů [[vodík]]u. | Oproti příbuznému [[nikl]]u je zastoupení kobaltu na Zemi i ve vesmíru výrazně nižší. V [[zemská kůra|zemské kůře]] činí průměrný obsah kobaltu kolem 25 mg/kg, čímž se zařazuje na 30. místo ve výskytu prvků na zemi. Jeho procentuální obsah odpovídá 29 ppm (''parts per milion'' = počet částic na 1 milion částic). V mořské [[voda|vodě]] se jeho koncentrace pohybuje na úrovni 0,27 mikrogramu v jednom litru. Předpokládá se, že ve [[vesmír]]u připadá na jeden atom kobaltu přibližně 15 milionů atomů [[vodík]]u. | ||
| - | V přírodě nejsou známa naleziště rud s převažujícím množstvím kobaltu. Ten vždy pouze doprovází niklové rudy a nalezneme jej i jako doprovodný prvek v sulfidických rudách [[měď|mědi]] nebo [[olovo|olova]]. Nejdůležitější nerosty kobaltu jsou '''''[[smaltin]]''''' CoAs<sub>3</sub>, '''''[[linnéit]]''''' Co<sub>3</sub>S<sub>4</sub> a '''''[[ | + | V přírodě nejsou známa naleziště rud s převažujícím množstvím kobaltu. Ten vždy pouze doprovází niklové rudy a nalezneme jej i jako doprovodný prvek v sulfidických rudách [[měď|mědi]] nebo [[olovo|olova]]. Nejdůležitější nerosty kobaltu jsou '''''[[smaltin]]''''' CoAs<sub>3</sub>, '''''[[linnéit]]''''' Co<sub>3</sub>S<sub>4</sub> a '''''[[kobaltin]]''''' CoAsS. V [[Nová Kaledonie|Nové Kaledonii]] se nachází [[magnan]]ová čerň, která obsahuje kobalt a nazývá se '''''[[asbolan]]'''''. |
| - | Největším zásoby rud s významným podílem kobaltu jsou v [[Rusko|Rusku]], [[Čína|Číně]], [[Austrálie|Austrálii]], [[Demokratická republika Kongo|Demokratické republice Kongo]] | + | <ref>[https://www.mindat.org/min-384.html Mindat.org – Asbolane]</ref> V ryzím stavu je možné nalézt kobalt v množství 0,5–2,5 % v [[železo|železných]] [[meteorit]]ech. |
| + | Největším zásoby rud s významným podílem kobaltu jsou v [[Rusko|Rusku]], [[Čína|Číně]], [[Austrálie|Austrálii]], [[Demokratická republika Kongo|Demokratické republice Kongo]] a [[Zambie|Zambii]]. Například roku 2005 se vytěžilo 22 000 tun kobaltových rud. | ||
== Výroba == | == Výroba == | ||
| - | Základ pro výrobu kobaltu tvoří tzv. ''míšně'', které se získávají při hutnickém zpracování rud [[nikl]]u, [[měď|mědi]] a [[olovo|olova]] obsahujících [[arsen]], kde je kobalt přítomen zejména jako [[arsenid]]. Z míšně se vyráběly [[oxid]]y kobaltu, které se používaly při výrobě kobaltových barev a nemusely být v příliš čistém stavu. Dnes se však vyrábí zejména kovový kobalt. | + | Základ pro výrobu kobaltu tvoří tzv. ''míšně'', které se získávají při hutnickém zpracování rud [[nikl]]u, [[měď|mědi]] a [[olovo|olova]] obsahujících [[arsen]], kde je kobalt přítomen zejména jako [[Arsenidy|arsenid]]. Z míšně se vyráběly [[oxid]]y kobaltu, které se používaly při výrobě kobaltových barev a nemusely být v příliš čistém stavu. Dnes se však vyrábí zejména kovový kobalt. |
| - | Příprava čistého kobaltu je velmi náročná, protože největší problém činí odstranit [[nikl]], který tvoří podstatnou část kobaltových rud. Nejčastěji se postupuje tak, že se rudy kobaltu nebo míšně pražením převedou na směs [[oxid]]ů a [[arseničnan]]ů, která se podle červeného zbarvení nazývá ''safor'' nebo ''cafra''. Tato směs se rozpustí v [[kyselina | + | Příprava čistého kobaltu je velmi náročná, protože největší problém činí odstranit [[nikl]], který tvoří podstatnou část kobaltových rud. Nejčastěji se postupuje tak, že se rudy kobaltu nebo míšně pražením převedou na směs [[oxid]]ů a [[arseničnan]]ů, která se podle červeného zbarvení nazývá ''safor'' nebo ''cafra''. Tato směs se rozpustí v [[kyselina chlorovodíková|kyselině chlorovodíkové]] a [[sulfan]]em se srazí [[měď]], [[olovo]], [[bismut]] a další těžké kovy. Po oxidaci [[Chlor|chlorem]] se srazí [[arsen]] a [[železo]] [[uhličitan vápenatý|uhličitanem vápenatým]] jako [[hydroxid železitý]] a [[arseničnan vápenatý]]. Pak se přidá [[chlorové vápno]] v takovém množství, aby se srazil jen kobalt, který se sráží přednostně před [[nikl]]em. Díky toho zůstane nikl přítomen v roztoku a kobalt, který je nyní přítomen v podobě svého oxidu se může od stop niklu ještě několiktrát přečistit. Nakonec se [[oxid kobaltnato-kobaltičitý]] redukuje [[uhlí]]m nebo [[koks]]em a získá se tak kovový kobalt. |
| + | |||
== Využití == | == Využití == | ||
Cena kobaltu je díky jeho poměrně nízkému výskytu i obtížnosti výroby dosti vysoká a v některých obdobích dosahuje burzovní cena kobaltu úrovně [[stříbro|stříbra]]. Proto je především v [[metalurgie|metalurgii]] využíván pouze v případech, kdy se nedá nahradit některým levnějším kovem a do slitin je legován obvykle jen v relativně nízkém množství. | Cena kobaltu je díky jeho poměrně nízkému výskytu i obtížnosti výroby dosti vysoká a v některých obdobích dosahuje burzovní cena kobaltu úrovně [[stříbro|stříbra]]. Proto je především v [[metalurgie|metalurgii]] využíván pouze v případech, kdy se nedá nahradit některým levnějším kovem a do slitin je legován obvykle jen v relativně nízkém množství. | ||
| Řádka 77: | Řádka 78: | ||
Odolnost kovového kobaltu proti vlivům prostředí (atmosférická oxidace, působení vody) znamená, že elektrolytickým vyloučením kobaltového povlaku na povrchu méně ušlechtilého kovu jej ochráníme proti korozi. | Odolnost kovového kobaltu proti vlivům prostředí (atmosférická oxidace, působení vody) znamená, že elektrolytickým vyloučením kobaltového povlaku na povrchu méně ušlechtilého kovu jej ochráníme proti korozi. | ||
=== Barvení skla a keramiky === | === Barvení skla a keramiky === | ||
| - | [[Soubor: | + | [[Soubor:Day 012 Cobalt Blue Glass Bottles.jpg|220px|thumb|Sklo obarvené kobaltovou modří]] |
Soli kobaltnaté i kobaltité jsou barevné, obvykle modré nebo červené. Přídavkem solí kobaltu do [[sklo]]viny nebo [[keramika|keramické]] hmoty se docílí toho, že výsledný výrobek je po vytavení a vypálení trvale zbarven. Toto znali a používali již staří Egypťané a Římané. | Soli kobaltnaté i kobaltité jsou barevné, obvykle modré nebo červené. Přídavkem solí kobaltu do [[sklo]]viny nebo [[keramika|keramické]] hmoty se docílí toho, že výsledný výrobek je po vytavení a vypálení trvale zbarven. Toto znali a používali již staří Egypťané a Římané. | ||
U keramických materiálů nebo [[porcelán]]u se však spíše používá tzv. glazování, kdy je primárně vypálený střep pokryt vrstvou tekuté '''[[glazura|glazury]],''' která jako barvicí [[pigment]]y obsahuje většinou soli různých těžkých kovů. Opětným vypálením předmětu v peci se glazura stabilizuje ve formě různých směsných [[oxid]]ů, [[křemičitan]]ů a dalších solí, které trvale zbarví její povrch. Protože barva glazovací směsi před vypálením je vždy jiná než po konečném tepelném zpracování, je finální vzhled výrobku vždy otázkou zkušenosti a řemeslné dovednosti keramika. | U keramických materiálů nebo [[porcelán]]u se však spíše používá tzv. glazování, kdy je primárně vypálený střep pokryt vrstvou tekuté '''[[glazura|glazury]],''' která jako barvicí [[pigment]]y obsahuje většinou soli různých těžkých kovů. Opětným vypálením předmětu v peci se glazura stabilizuje ve formě různých směsných [[oxid]]ů, [[křemičitan]]ů a dalších solí, které trvale zbarví její povrch. Protože barva glazovací směsi před vypálením je vždy jiná než po konečném tepelném zpracování, je finální vzhled výrobku vždy otázkou zkušenosti a řemeslné dovednosti keramika. | ||
| Řádka 95: | Řádka 96: | ||
==== Sloučeniny kobaltnaté Co<sup>2+</sup> ==== | ==== Sloučeniny kobaltnaté Co<sup>2+</sup> ==== | ||
| - | [[Soubor:Basic-cobalt(II)-carbonate.jpg|thumb| | + | [[Soubor:Basic-cobalt(II)-carbonate.jpg|thumb|220px|Uhličitan kobaltnatý]] |
| - | [[Soubor:Cobalt(II)-chloride-hexahydrate-sample.jpg|thumb| | + | [[Soubor:Cobalt(II)-chloride-hexahydrate-sample.jpg|thumb|220px|Chlorid kobaltnatý]] |
| - | [[Soubor:Cobalt(II)-nitrate-photo.jpg|thumb| | + | [[Soubor:Cobalt(II)-nitrate-photo.jpg|thumb|220px|Dusičnan kobaltnatý]] |
* [[Oxid kobaltnatý]] CoO je olivově zelený prášek, nerozpustný ve vodě, rozpustný v kyselinách na kobaltnaté soli. Barva oxidu kobaltnatého závisí na velikosti částic, stejně jako nejčastěji zelený, lze také připravit žlutý, šedý, hnědý, slabě červený, namodralý nebo černý. [[Oxid kobaltnatý]] vzniká zahříváním [[hydroxid kobaltnatý|hydroxidu kobaltnatého]] nebo [[uhličitan kobaltnatý|uhličitanu kobaltnatého]] za nepřístupu [[vzduch]]u. Za normálních teplot má [[antiferromagnetismus|antiferromagnetické]] vlastnosti. Žíháním při teplotách 400-500 °C se získá [[oxid kobaltnato-kobaltitý]] Co<sub>3</sub>O<sub>4</sub>. | * [[Oxid kobaltnatý]] CoO je olivově zelený prášek, nerozpustný ve vodě, rozpustný v kyselinách na kobaltnaté soli. Barva oxidu kobaltnatého závisí na velikosti částic, stejně jako nejčastěji zelený, lze také připravit žlutý, šedý, hnědý, slabě červený, namodralý nebo černý. [[Oxid kobaltnatý]] vzniká zahříváním [[hydroxid kobaltnatý|hydroxidu kobaltnatého]] nebo [[uhličitan kobaltnatý|uhličitanu kobaltnatého]] za nepřístupu [[vzduch]]u. Za normálních teplot má [[antiferromagnetismus|antiferromagnetické]] vlastnosti. Žíháním při teplotách 400-500 °C se získá [[oxid kobaltnato-kobaltitý]] Co<sub>3</sub>O<sub>4</sub>. | ||
* [[Hydroxid kobaltnatý]] Co(OH)<sub>2</sub> je v čerstvém stavu zprvu modrá sraženina, která se stáním zbarvuje do světle růžové barvy, je nerozpustná ve vodě, rozpustná v [[kyselina|kyselinách]] na kobaltnaté soli. Za přístupu [[vzduch]]u se sraženina oxiduje na hydratovaný [[oxid kobaltitý]]. Za přítomnosti oxidačních činidel v roztoku je možno získat až hydratovaný [[oxid kobaltičitý]], který ale není v čistém stavu. [[Hydroxid kobaltnatý]] se připravuje přidáním alkalického [[hydroxid]]u k roztoku kobaltnaté soli. | * [[Hydroxid kobaltnatý]] Co(OH)<sub>2</sub> je v čerstvém stavu zprvu modrá sraženina, která se stáním zbarvuje do světle růžové barvy, je nerozpustná ve vodě, rozpustná v [[kyselina|kyselinách]] na kobaltnaté soli. Za přístupu [[vzduch]]u se sraženina oxiduje na hydratovaný [[oxid kobaltitý]]. Za přítomnosti oxidačních činidel v roztoku je možno získat až hydratovaný [[oxid kobaltičitý]], který ale není v čistém stavu. [[Hydroxid kobaltnatý]] se připravuje přidáním alkalického [[hydroxid]]u k roztoku kobaltnaté soli. | ||
| Řádka 157: | Řádka 158: | ||
* N. N. Greenwood - A. Earnshaw, ''Chemie prvků'' 1. díl, 1. vydání 1993 ISBN 80-85427-38-9 | * N. N. Greenwood - A. Earnshaw, ''Chemie prvků'' 1. díl, 1. vydání 1993 ISBN 80-85427-38-9 | ||
| + | == YouTube == | ||
| + | {| border="4" width="442" align="left" | ||
| + | | {{#widget:YouTube|id=7iMN7M5YLyI}} | ||
| + | |- align="center" | ||
| + | | '''Here’s Why Companies Are Scrambling For Cobalt''' | ||
| + | |} | ||
| + | {| border="4" width="442" align="right" | ||
| + | | {{#widget:YouTube|id=Y9jscWk2DMg}} | ||
| + | |- align="center" | ||
| + | | '''Blood, Sweat, and Batteries: Inside Congo's Cobalt Mines''' | ||
| + | |} | ||
| + | <br style="clear: both;" /> | ||
== Reference == | == Reference == | ||
<references /> | <references /> | ||
| Řádka 167: | Řádka 180: | ||
* [http://www.nlm.nih.gov/medlineplus/ency/article/002495.htm Možná zdravotní rizika] | * [http://www.nlm.nih.gov/medlineplus/ency/article/002495.htm Možná zdravotní rizika] | ||
| - | {{ | + | |
| - | {{ | + | {{Flickr|Cobalt}}{{Commonscat|Cobalt}}{{Článek z Wikipedie}}{{Tabulka prvků}} |
[[Kategorie:Chemické prvky]] | [[Kategorie:Chemické prvky]] | ||
[[Kategorie:Kovy]] | [[Kategorie:Kovy]] | ||
| + | [[Kategorie:Video články Multimediaexpo.cz]] | ||
Aktuální verze z 30. 11. 2021, 11:30
| Kobalt | |
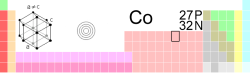
| |
| Atomové číslo | 27 |
| Relativní atomová hmotnost | 58.933195(5) amu |
| Elektronová konfigurace | [Ar] 3d7 4s2 |
| Skupenství | Pevné |
| Oxidační čísla | Co1-, Co1+, Co2+, Co3+, Co4+, Co5+ |
| Teplota tání | 1 495 °C, (1 768 K) |
| Teplota varu | 3 100 °C, (3 473 K) |
| Vzhled | 
|
| Elektronegativita (Pauling) | 1,88 |
| Počet přírodních izotopů | 1 |
| Hustota | 8,90 g/cm3 |
| Hustota při teplotě tání | 7,75 g/cm3 |
| Tvrdost | 5,0 |
| Registrační číslo CAS | 7440-48-4 |
| Specifické teplo | 0,0928 kJ/mol |
| Atomový poloměr | 1,25 Å |
| Iontový poloměr Co2+ | 0,65 Å nebo 0,74 Å (nízkospinové a vysokospinové uspořádání) |
| Iontový poloměr Co3+ | 0,54 Å nebo 0,61 Å (nízkospinové a vysokospinové uspořádání) |
| Iontový poloměr Co4+ | 0,53 |
| Skupenské teplo tání | 16,3 kJ/mol |
| Skupenské teplo varu | 382 kJ/mol |
| Slučovací teplo | 425 kJ/mol |
| Elektrický odpor při 20 °C | 6,24 μΩ |
Obsah |
Základní fyzikálně - chemické vlastnosti
Typický kovový ferromagnetický prvek, stříbrolesklý s modrým nádechem. Je velmi pevný, svou tvrdostí a pevností předčí ocel. Kobalt je feromagnetický do teploty 1000 °C, nad touto teplotou své feromagnetické vlastnosti ztrácí. Bod při němž kov ztrácí feromagnetické vlastnosti se nazývá Curieův bod. Kobalt patří mezi přechodné prvky, které mají valenční elektrony v d-sféře. Ve sloučeninách se vyskytuje především v mocenství Co+II a Co+III, vzácně se můžeme setkat i s Co+I, Co+IV a od nedávna také s některými nestabilními sloučeninami v oxidačním stavu Co+V například Na3CoVO4. Kobalt se vyskytuje v přírodě ve dvou alotropických modifikacích označovaných α-Co a β-Co. První je stabilní za obyčejné teploty a kobalt v ní zaujímá těsné uspořádání v hexagonální mřížce. Druhá modifikace je stabilní nad teplotou 417 °C a kobalt v ní zaujímá uspořádání atomů v plošně centrované kubické mřížce. Přeměna mezi modifikacemi je malá, což má vliv na fyzikální vlastnosti kovu. V kompaktním stavu je kobalt vůči vzduchu i vodě stabilní. V jemně rozptýleném stavu je kobalt stejně jako železo pyroforický (je samozápalný na vzduchu). Ve zředěných kyselinách, jako je kyselina chlorovodíková, kyselina sírová a kyselina dusičná, se rozpouští, ale velmi neochotně a pomalu. V koncentrované kyselině dusičné se kobalt, stejně jako železo pouze pasivuje. Při zahřívání shoří kobalt na vzduchu na oxid kobaltnato-kobaltitý Co3O4. Při zahřívání na vzduchu nad 900 °C shoří kobalt na oxid kobaltnatý CoO. Ten vzniká i při působení vodní páry na kov zahřátý do červeného žáru. Za normální teploty je kobalt málo reaktivní, ale za vyšších teplot se často za vzniku plamene slučuje s mnoha prvky (síra, fosfor, arsen, antimon, cín, zinek, křemík, bor, halogeny…). Neslučuje se však s dusíkem a vodíkem.
Historický vývoj
O prvním používaní sloučenin kobaltu se dozvídáme z egyptských archeologických nálezů. Ty pochází z doby 2600 př. n. l. a jedná se keramiku a skleněné perly, které byly barveny kobaltovou modří do modra. Horníci ve středověku označovali jako kobalty rudy, které se i přes svůj kovový vzhled nedaly hutnicky zpracovat na kov. Jméno kobalt má základ v německém pojmenování skřítků Koboltů, kteří byly spíše zlomyslní a kazili horníkům práci. Přítomnost kobaltu totiž zhoršovala kvalitu a zpracovatelnost vytěžených niklových rud a kobaltové příměsi i více ohrožovaly jejich zdraví, protože se při jejich pražení uvolňovaly nebezpečné jedovaté plyny s obsahem As4O6. Později se toto označení omezilo pouze na rudy, které se daly obtížně hutnicky zpracovat a barvily sklo na modro. Kov, který byl součástí těchto rud, objevil roku 1735 švédský chemik Georg Bradnt a nazval jej cobalt rex a roku 1780 T. O. Bergman ukázal, že jde o nový prvek.
Výskyt
Oproti příbuznému niklu je zastoupení kobaltu na Zemi i ve vesmíru výrazně nižší. V zemské kůře činí průměrný obsah kobaltu kolem 25 mg/kg, čímž se zařazuje na 30. místo ve výskytu prvků na zemi. Jeho procentuální obsah odpovídá 29 ppm (parts per milion = počet částic na 1 milion částic). V mořské vodě se jeho koncentrace pohybuje na úrovni 0,27 mikrogramu v jednom litru. Předpokládá se, že ve vesmíru připadá na jeden atom kobaltu přibližně 15 milionů atomů vodíku. V přírodě nejsou známa naleziště rud s převažujícím množstvím kobaltu. Ten vždy pouze doprovází niklové rudy a nalezneme jej i jako doprovodný prvek v sulfidických rudách mědi nebo olova. Nejdůležitější nerosty kobaltu jsou smaltin CoAs3, linnéit Co3S4 a kobaltin CoAsS. V Nové Kaledonii se nachází magnanová čerň, která obsahuje kobalt a nazývá se asbolan. [1] V ryzím stavu je možné nalézt kobalt v množství 0,5–2,5 % v železných meteoritech. Největším zásoby rud s významným podílem kobaltu jsou v Rusku, Číně, Austrálii, Demokratické republice Kongo a Zambii. Například roku 2005 se vytěžilo 22 000 tun kobaltových rud.
Výroba
Základ pro výrobu kobaltu tvoří tzv. míšně, které se získávají při hutnickém zpracování rud niklu, mědi a olova obsahujících arsen, kde je kobalt přítomen zejména jako arsenid. Z míšně se vyráběly oxidy kobaltu, které se používaly při výrobě kobaltových barev a nemusely být v příliš čistém stavu. Dnes se však vyrábí zejména kovový kobalt. Příprava čistého kobaltu je velmi náročná, protože největší problém činí odstranit nikl, který tvoří podstatnou část kobaltových rud. Nejčastěji se postupuje tak, že se rudy kobaltu nebo míšně pražením převedou na směs oxidů a arseničnanů, která se podle červeného zbarvení nazývá safor nebo cafra. Tato směs se rozpustí v kyselině chlorovodíkové a sulfanem se srazí měď, olovo, bismut a další těžké kovy. Po oxidaci chlorem se srazí arsen a železo uhličitanem vápenatým jako hydroxid železitý a arseničnan vápenatý. Pak se přidá chlorové vápno v takovém množství, aby se srazil jen kobalt, který se sráží přednostně před niklem. Díky toho zůstane nikl přítomen v roztoku a kobalt, který je nyní přítomen v podobě svého oxidu se může od stop niklu ještě několiktrát přečistit. Nakonec se oxid kobaltnato-kobaltičitý redukuje uhlím nebo koksem a získá se tak kovový kobalt.
Využití
Cena kobaltu je díky jeho poměrně nízkému výskytu i obtížnosti výroby dosti vysoká a v některých obdobích dosahuje burzovní cena kobaltu úrovně stříbra. Proto je především v metalurgii využíván pouze v případech, kdy se nedá nahradit některým levnějším kovem a do slitin je legován obvykle jen v relativně nízkém množství.
Slitiny
V ocelářském průmyslu slouží kobalt jako složka speciálních nástrojových ocelí, které musí vykazovat vynikající mechanické vlastnosti – tvrdost, pevnost a odolnost. Z ocelí tohoto typu se vyrábějí nástroje a přípravky pro obrábění kovů (rychlořezná ocel), ale i např. turbiny plynových generátorů a leteckých motorů, vrtné hlavice pro geologický průzkum. Rychlořezná ocel dovoluje pracovat na soustruhu s větší rychlostí, protože si uchvává svou tvrdost i v červeném žáru. Ještě lepší jsou však řezné slitiny, které mají obvzláště velkou tvrdost. Jsou to například widia a stellit. Tyto slitiny se používají k výrobě řezných nástorjů k vrtání hornin. Widia (název pochází z německého wie Diamant - jako diamant) se skládá z karbidu wolframu a asi 10 % kobaltu. Stellit se skládá z 50 % kobaltu, 27 % chromu , 12 % wolframu, 2,5 uhlíku a až 5 % železa, ve stopové množství ještě obsahuje mangan a křemík. Pro výrobu velmi silných permanentních magnetů se používá typ slitin s obchodním názvem Alnico, které se skládají ze železa, kobaltu, niklu, hliníku a mědi. Jde o velmi silný permanatní magnet, který překoná 25krát výkon ocelových magnetů. Pro pacienty, kteří si nemohou dovolit uhradit běžné dentální slitiny z drahých kovů se jako levná varianta používá několik typů slitin bázi kobaltu, molybdenu, wolframu a niklu. Tento materiál velmi dobře odolává korozním vlivům, ale obtížně se zpracovává pro velmi vysokou tvrdost a vysoký bod tání.
Galvanické pokovování
Odolnost kovového kobaltu proti vlivům prostředí (atmosférická oxidace, působení vody) znamená, že elektrolytickým vyloučením kobaltového povlaku na povrchu méně ušlechtilého kovu jej ochráníme proti korozi.
Barvení skla a keramiky
Soli kobaltnaté i kobaltité jsou barevné, obvykle modré nebo červené. Přídavkem solí kobaltu do skloviny nebo keramické hmoty se docílí toho, že výsledný výrobek je po vytavení a vypálení trvale zbarven. Toto znali a používali již staří Egypťané a Římané. U keramických materiálů nebo porcelánu se však spíše používá tzv. glazování, kdy je primárně vypálený střep pokryt vrstvou tekuté glazury, která jako barvicí pigmenty obsahuje většinou soli různých těžkých kovů. Opětným vypálením předmětu v peci se glazura stabilizuje ve formě různých směsných oxidů, křemičitanů a dalších solí, které trvale zbarví její povrch. Protože barva glazovací směsi před vypálením je vždy jiná než po konečném tepelném zpracování, je finální vzhled výrobku vždy otázkou zkušenosti a řemeslné dovednosti keramika. V keramickém průmyslu se kobalt dnes používá zejména jako bělidlo k optickému vyrovnání žlutavého nádechu, který vytváří železnaté sloučeniny.
Zdroj radioaktivního záření
Ozářením stabilního izotopu kobaltu 59Co energetickými neutrony (např. v jaderném reaktoru) vzniká nestabilní 60Co. Tento radioizotop se rozpadá s poločasem 5,2714 let za uvolňování silného gama-záření. Kobalt byl z tohoto důvodu někdy zvažován pro použití ve svrchním plášti jaderné bomby (takzvaná kobaltová bomba), po výbuchu by došlo k výše zmíněné transmutaci a zamoření oblasti radioizotopem 60Co (praktická aplikace tohoto typu není známa). Protože 60Co lze poměrně snadno připravit a manipulace s ním není obtížná, využívá se v medicíně jako zdroj gama-paprsků pro ozařování rakovinných nádorů a dalších tkání. Přístroj pro ozařování se nazývá kobaltové dělo a jeho podstatou je silná olověná ochranná schránka válcovitého tvaru, která propouští potřebné gama-záření pouze v úzkém paprsku určeným směrem. Izotop 60Co je využíván i v defektoskopii pro vyhledáváni vnitřních skrytých vad materiálů. Uvolněným zářením jsou prozařovány kovové součásti důležitých aparatur – zařízení pro jaderný průmysl, chemické reaktory pro vysoké tlaky, části kosmických raket apod. Citlivý detektor snímá množství gama paprsků, které materiálem projdou a výskyt vady (trhliny, chybného svaru) se projeví změnou intenzity měřeného záření. Ozařování gama-paprsky slouží i k likvidaci hub, plísní a dřevokazného hmyzu v historicky cenných dřevěných předmětech, které není možno ošetřit klasickými chemickými přípravky kvůli zachování jejich vzhledu.
Sloučeniny
Kobalt dokáže tvořit sloučeniny v oxidačních stavech od Co1- do Co5+, avšak většina jednoduchých sloučenin kobaltu se odvozuje od dvojmocného kobaltu a většina komplexních slučenin se odvozuje od trojmocného kobaltu. V organokovových sloučeninách může kobalt dosáhnout i nižších oxidačních čísel.
Anorganické sloučeniny
V anorganických sloučeninách kobalt vystupuje v oxidačních stavech od Co1+ do Co5+, přičemž největší význam mají sloučeniny kobaltnaté a kobaltité. V dalších oxidačních stavech jsou sloučeniny nestabilní, a proto nemají praktický význam. Jednoduché anorganické sloučeniny tvoří více kobaltnaté soli a komplexní tvoří více kobaltité soli.
Sloučeniny kobaltnaté Co2+
- Oxid kobaltnatý CoO je olivově zelený prášek, nerozpustný ve vodě, rozpustný v kyselinách na kobaltnaté soli. Barva oxidu kobaltnatého závisí na velikosti částic, stejně jako nejčastěji zelený, lze také připravit žlutý, šedý, hnědý, slabě červený, namodralý nebo černý. Oxid kobaltnatý vzniká zahříváním hydroxidu kobaltnatého nebo uhličitanu kobaltnatého za nepřístupu vzduchu. Za normálních teplot má antiferromagnetické vlastnosti. Žíháním při teplotách 400-500 °C se získá oxid kobaltnato-kobaltitý Co3O4.
- Hydroxid kobaltnatý Co(OH)2 je v čerstvém stavu zprvu modrá sraženina, která se stáním zbarvuje do světle růžové barvy, je nerozpustná ve vodě, rozpustná v kyselinách na kobaltnaté soli. Za přístupu vzduchu se sraženina oxiduje na hydratovaný oxid kobaltitý. Za přítomnosti oxidačních činidel v roztoku je možno získat až hydratovaný oxid kobaltičitý, který ale není v čistém stavu. Hydroxid kobaltnatý se připravuje přidáním alkalického hydroxidu k roztoku kobaltnaté soli.
- Sulfid kobaltnatý CoS je černý prášek, nerozpustný ve vodě, hydroxidech ani zředěných kyselinách, v koncentrovaných se rozpouští za vzniku sulfanu. Vzniká srážením roztoků kobaltnatých solí alkalickým sulfidem nebo sulfanem.
- Chlorid kobaltnatý CoCl2 je v bezvoém stavu bledě modrý prášek, silně hygroskopický, který postupnou hydratací přechází přes modrofialový, tmavě fialový, růžově fialový, broskvově fialový až k růžovému hexahydrátu, těchto barevných pochodů se využívá v silikagelu, do kterého se přidává jako indikátor množství obsaželené vlhkosti. Chlorid kobaltnatý je dobře rozpustný ve vodě, lihu, acetonu, chinolinu a benzonitrilu. Chlorid kobaltnatý vytváří v roztoku podvojné i komplexní sloučeniny (viz níže) chlorokobaltnatany. Chlorid kobaltnatý se připravuje spalováním kobaltu v proudu chloru.
- Bromid kobaltnatý CoBr2 je v bezvodém stavu zelená krystalická látka, v hydratované podobě tvoří červenou krystalickou látku, dobře rozpustnou ve vodě. V roztoku tvoří komplexní sloučeniny (viz níže) bromokobaltnatany. Bromid kobaltnatý se připravuje spalováním kobaltu v parách bromu.
- Jodid kobaltnatý CoI2 je v bezvodém stavu zelenošedý prášek, v hydratované podobě je to tmavě červená krystalická látka, dobře rozpustná ve vodě, lihu a acetonu. V roztocích tvoří komplexní sloučeniny (viz níže) jodokobaltnatany. Jodid kobaltnatý se připravuje spalováním kobaltu v parách jodu.
- Fluorid kobaltnatý CoF2 je v bezvodém stavu načervenalá krystalická látka, v hydratované podobě růžová krystalická látka, špatně rozpustná ve vodě. V roztoku tvoří komplexní sloučeniny (viz níže) fluorokobaltnatany. Připravuje se rozpouštěním uhličitanu kobaltnatého v kyselině fluorovodíkové.
- Kyanid kobaltnatý Co(CN)2 je látka nerozpustná ve vodě a kyselinách, ale rozpustná v roztoku amoniaku a uhličitanu amonném. V roztoku vytváří za normální teploty komplexní sloučeniny (viz níže) kyanokobaltnatany, za vyšší teploty však samovolně přechází v kyanokobaltitany. Kyanid kobaltnatý se připravuje srážením rozpustné kobaltnaté soli rozpustným kyanidem.
- Rhodanid kobaltnatý Co(SCN)2 je v hydratované podobě červenofialová krystalická látka, dobře rozpustná ve vodě. Při velké koncentraci v roztoku je barva rozpuštěné soli tmavě modrá a při zřeďování přechází do červené. Rhodanid kobaltnatý vytváří v roztoku komplexní sloučeniny (viz níže) rhodanokobaltnatany. Rhodanid kobaltnatý se připravuje rozpouštěním uhličitanu kobaltnatého v kyselině rhodanovodíkové nebo reakcí rhodanidu barnatého se síranem kobaltnatým.
- Dusičnan kobaltnatý Co(NO3)2 je v hydratované podobě červená krystalická látka, dobře rozpustná ve vodě. Používá se v analytická chemii a v keramickém průmyslu. Při zahřívání se rozkládá na oxid kobaltnatý, oxid dusičitý a kyslík. Připravuje se rozpouštěním uhličitanu kobaltnatého v kyselině dusičné.
- Síran kobaltnatý CoSO4 se v podobě svého heptahydrátu označuje jako kobaltnatá skalice, má karmínově červenou barvu a je dobře rozpustný ve vodě. V roztoku vytváří podvojné sírany se sírany alkalických kovů. Připrwavuje se rozpouštěním uhličitanu kobaltnatého nabo oxidu kobaltnatého v zředěné kyselině sírové.
- Uhličitan kobaltnatý CoCO3 je v čisté podobě fialovočervený prášek, nerozpustný ve vodě. V roztoku vytváří podvojné sloučeniny. Při klasickém srážení kobaltnaté soli roztokem alkalického uhličitanu vznikají zásadité uhličitany, které mají modrou barvu. Pokud se však kobaltnatá sůl sráží v roztoku nasyceném oxidem uhličitým, vznikne hexahydrát uhličitanu kobaltnatého.
Sloučeniny kobaltité Co3+
- Oxid kobaltitý Co2O3 je v bezvodém stavu hnědý prášek, nerozpustný ve vodě, rozpustný v kyselinách na kobaltnaté soli a v koncentrovaném vroucím alkalickém hydroxidu na tetrahydroxokobaltnatany nebo hexahydroxokobaltnatany. V přírodě se vyskytuje jako nerost stainierit. Připravuje se oxidací hydroxidu kobaltnatého, ale pouze ve své hydratované podobě. Žíhání na bezvodý oxid kobaltitý lze provést pouze za zvláštních podmínek. Běžně totiž dochází při zahřívání k odštěpení kyslíku a vzniku oxidu kobaltnato-kobaltitého.
- Fluorid kobaltitý CoF3 je v bezvodém stavu hnědý prášek, v hydratované podobě chromově zelený prášek, rozpustný ve vodě, ale vodou se rozkládá. V roztoku lze připravit komplexní sloučeniny (viz níže) fluorokobaltitany. Připravuje se působením fluoru na chlorid kobaltnatý nebo přímou fluorací kovu.
- Síran kobaltitý Co2(SO4)3 je modrá krystalická látka, která se ve vodě ihned rozkládá za vývoje kyslíku, v kyselině sírové se rozpouští bez rozkladu. Síran kobaltitý tvoří v roztoku se sírany alkalických kovů podvojné sírany - kamence. Síran kobaltitý se dá připravit elektrolýzou koncentrovaného roztoku síranu kobaltnatého okyseleného kyselinou sírovou za použití diafragmy a chlazené anody.
Sloučeniny kobaltičité Co4+
Toto oxidační stejně jako Co5+ není pro sloučeniny kobaltu typické a kobalt v něm vytváří pouze několik sloučenin. Oxid kobaltičitý CoO2 je nestabilní látka, ale má schopnost tvořit soli se zásadotvornými oxidy - kobaltičitany. Ty jsou ovšem také nestabilní, stjně jako oxid sám. Doposud se podařili připravit Sr2CoO4 a Ba2CoO4. Tyto sloučeniny nemají praktický význam. Tyto sloučeniny se připrvují oxidu a chloridu alkalického kovu nebo kovu alkalické zeminy s oxidem kobaltitým za přístupu vzduchu.
Komplexní sloučeniny
Nejvíce koordinačních sloučenin tvoří kobalt v oxidačních číslech II a III. Velmi neochotně tvoří oxoaniony, s výjimkou CoVO43- a CoIIO34-.
Oxidační stav IV (d5)
Komplexních sloučenin kobaltu s oxidačním číslem IV je málo. Například některé sloučeniny s fluorem a smíšené oxidy kovu (většinou málo čisté).
Oxidační stav III (d6)
Komplexy trojocného kobaltu jsou teměř bez výjimky nízkospinové, oktaedrické a velmi stabilní (LFSE = 2,4 Δo). Nestálost hexaaquakobaltitého kationtu [Co(H2O)6]3+ je způsobena jeho oxidačními schopnosti. Rozkládá se, pokud není roztok kyselý (pH < 7), oxiduje dokonce vodu za vývoje kyslíku. Je však přítomen v celé řadě solí: modrý oktadekahydrát síranu kobaltitého Co2(SO4)3•18H2O nebo podvojné soli MCo(SO4)2•12H2O (M = K, Rb, Cs a NH4). Vysokospinové kobaltité komplexy jsou pouze fluorokobaltitany [CoF6]3- a častěji I[CoF5]2-. CoIII poskytuje mnoho komplexních koordinačních sloučenin, a to zvláště s dusíkatými donorovými ligandy. Nejvýznamnější jsou amoniakáty kobaltité [Co(NH3)6]3+, [Co(NH3)6X]2+ a [Co(NH3)6X2]+. Tyto sloučeniny vynikají pestrou barevností a dobrou stálostí na vzduchu i v roztoku, vyskytuje se u nich také mnoho izomerií. K velmi známým amoniakátům patří amonikáty chloridu kobaltitého. K nejznámějším z nich patří oranžově žlutý chlorid hexaamminkobaltitý [Co(NH3)6]Cl3 dříve známý jako luteochlorid kobaltitý, červený chlorid pentaammin-aquakobaltitý [Co(NH3)5(H2O)]Cl3 dříve známý jako roseochlorid kobaltitý, purpurový chlorid chloro-pentaamminkobaltitý [CoCl(NH3)5]Cl2 dříve známý jako purpureochlorid kobaltitý, chlorid dichloro-tetraamminkobaltitý [CoCl2(NH3)4]Cl, která je známa ve dvou izomerních formách cis a trans, v cis formě je tato sloučenina modrofialová a je známa jako violeochlorid kobaltitý a v trans formě zelená a známa jako praseochlorid kobaltitý. Další známé komplexy jsou žlutě zbarvený chlorid pentaamin-nitrátokobaltitý [Co(NH3)5NO2]Cl2 dříve známý jako xanthochlorid kobaltitý, chlorid tetraammin-dinitrokobaltitý [Co(NH3)4(NO2)2]Cl, která je známa ve dvou izomerních formách cis a trans, v cis formě je tato sloučenina žlutá a je známa jako flavochlorid kobaltitý a v trans formě šafránově zbarvená a známa jako croceochlorid kobaltitý. Toto staré triviální názvosloví se stalo základem prvního názvosloví komplexů, které se přeneslo i na sloučeniny jiné než chloridů a kobaltitého kationu a to i přesto, že barvy komplexů jiných kationů kovů neodpovídali - např. [Cr(NH3)5(H2O)]Br3 se pojmenoval roseobromid chromitý, a to i přesto, že sloučenina není červená, ale bílá až světle oranžová. Dalšími stabilními dusíkatými komplexy jsou hexanitrokobaltitany [Co(NO2)6]3-. Tyto komplexní sloučeniny mají žluté až oranžové zbarvení a jsou málo rozpustné ve vodě. Oranžový hexanitrokobaltitan sodný Na3[Co(NO2)6] se připravuje smísením roztoků dusičnanu kobaltitého, dusitanu sodného a kyseliny octové za provádění vzduchem. Sodná sůl se používá jako zkoumadlo na draselné soli, protože hexanitrokobaltitan draselný K3[Co(NO2)6] známý pod názvem Fischerova sůl je ve vodě nerozpustný. Působením fluoru vzniká vysokospinový paramagnetický hexafluorokobaltitan draselný K3[CoF6]. Stálé jsou i hexakyanokobaltitany [Co(CN)6]3-. Jsou to žluté krystalické netoxické látky, které vznikají oxidací kyanokobaltnatanů. Volnou kyselinu kyanokobaltitou získáme působením sulfanu na sraženinu kyanokobaltitanu olovnatého. Komplexy s kyslíkovými donory jsou méně stálé. Výjimkou jsou zelené penta-2,4-dionátové (acetylacetonátové) komplexy [Co(acac)3] a oxalatokobaltitany [Co(C2O4)3]3-, které mají také zelenou barvu a připravují se rozpouštěním hydratovaného oxidu kobaltitého v koncentrovaném roztoku kyseliny šťavelové a následným sražením alkalickým uhličitanem. K významnějším komplexům patří Durantova sůl K2[Co(OH)(C2O4)2(H2O)].
Kobaltité komplexy jsou odolné vůči hydrolýze, pokud k ní přeci jenom dojde, vznikají vícejaderné komplexy s můstkovými ligandy OH-, NH2-, NH2- a NO22-.
Oxidační stav II (d7)
CoII tvoří s většinou známých aniontů jednoduché soli, které krystalizují v podobě hydrátů. Obsahují růžový kationt hexaaquakolbaltnatý [Co(H2O)6]2+. Pokud se do vodného roztoku přidá alkalická látka, vzniká hydroxid kobaltnatý Co(OH)2 s amfoterním charakterem. V nadbytku konc. hydroxidů vznikají tmavě modré roztoky tetrahydroxokobaltnatanů [Co(OH)4]2-. Pomalým srážením z roztoku při teplotě 0 ˚C vzniká nestálá modrá forma hydroxidu kobaltnatého. Zahříváním za nepřístupu vzduchu přechází na růžovou. Kobaltnaté komplexy jsou oproti kobaltitým méně početné, méně stabilní a náchylné k oxidaci. Nejběžnější jsou vysokospinové oktaedrické komplexy. Dokonce i kompex [Co(H2O)edta]- dodržuje koordinační číslo 6 a chelaton III (edta, kyselina ethylendiamintetraoctová) má jeden kyslíkový atom nekoordinovaný (chová se jako pětivazný ligand). Větší stálost vůči oxidaci mají kationtové ligandy [Co(L-L)3]2+, obsahující dvoudonorové dusíkaté ligandy jako en (ethylendiamin), bipy (bipyridyl) a phen (fenanthrolin). Běžné jsou také modré tetraedrické komplexy, neboť při konfiguraci d7 jsou výhodné (LFSE = 6/5 Δt). Obsahují aniont [CoX4]2-, kde X = F, Cl, Br, I, SCN a OH. Chloro-, bromo- a jodokobaltnatany existují výjimečně i v oktaedrickém uspořádání. Oktaedrické kyanokobaltnatany jsou stálé pouze v atmosféře vodíku za normální teploty. Amoniakáty kobaltnaté jsou komplexní sloučeniny, ve kterých se komplexně vázané molekuly vody nahradily molekulami amoniaku, většinou jde o červené nebo o světle červené látky. Například chlorid hexaamminkobaltnatý [Co(NH3)6]Cl2. Karboxyláty CoII, např. červený octan [Co(OOCCH3)2]•4H2O, jsou na rozdíl od analogických sloučenin Rh monomerní a v některých případech je acetátový ligand jednodorový. Octan kobaltnatý je součástí katalyzátorů používaných v organické chemii při oxidacích, urychluje také schnutí laků a fermeže.
Organické sloučeniny
K organickým sloučeninám kobaltu patří soli organických kyselin a zejména organokovové sloučeniny kobaltu.
- Šťavelan kobaltnatý CoC2O4 je světle růžový prášek, nerozpustný ve vodě. V roztoku lze získat podvojné sloučeniny, které mají červenou barvu a jsou rozpustné ve vodě. Připravuje se srážením roztoku kobaltnaté soli rozpustným šťavelanem.
- Octan kobaltnatý Co(CH3COO)2 je červená krystalická látka, dobře rozpustná ve vodě. Používá se jako bělící prostředek a jako sušidlo do laků a fermeží. Připravuje se rozpouštěním uhličitanu kobaltnatého v kyselině octové.
Biologický význam a zdravotní rizika
Stopové množství kobaltu je důležité pro řadu živých organismů včetně člověka. Koncentrace několika desetin miligramů kobaltu na kilogram půdy prokazatelně zlepšuje zdravotní stav pasoucího se dobytka. Kobalt je také součástí jednoho z důležitých členů vitaminů skupiny B, vitaminu B12. Otrava kobaltem může nastat pouze v případě vystaveni organizmu velkému množství kobaltu. Kobalt se přitom může do organizmu dostat v potravě, vdechováním prachu či aerosolu nebo při dlouhodobém kontaktu s pokožkou. Přiznaky otravy se pak projeví obvykle po několika týdnech nebo i měsících trvalé expozice vysokými dávkami kobaltu. Obvykle se proto mohou vyskytnou prakticky pouze v průmyslových provozech pro zpracování kobaltu nebo jeho sloučenin. Při dlouhodobé expozici prachem byly pozorovány problémy s dýcháním podobné astmatu nebo trvalejší problémy, jako je plicní fibróza. Stálý kontakt s pokožkou může způsobit podráždění a kožní vyrážky, které jen pomalu mizí. Potravní přijem velkého množství kobaltu najednou je velmi vzácný a pravděpodobně nebude příliš nebezpečný. Může způsobit nevolnost a zvracení, při dlouhodobém příjmu jsou pak známy problémy se štítnou žlázou, neurologické problémy a zvýšení krevní hustoty. [2]
Literatura
- Cotton F.A., Wilkinson J.:Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973
- Holzbecher Z.:Analytická chemie, SNTL, Praha 1974
- Dr. Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- N. N. Greenwood - A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993 ISBN 80-85427-38-9
YouTube
| Here’s Why Companies Are Scrambling For Cobalt |
| Blood, Sweat, and Batteries: Inside Congo's Cobalt Mines |
Reference
Externí odkazy
- Periodická soustava a tabulka vlastností prvků
- Chemický vzdělávací portál
- WebElements (anglicky)
- Periodická tabulka prvků
- obecné vlastnosti, anglicky
- Možná zdravotní rizika
|
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |





