Multimediaexpo.cz je již 18 let na českém internetu !!
V tiskové zprávě k 18. narozeninám brzy najdete nové a zásadní informace.
Oxid uhličitý
Z Multimediaexpo.cz
(+ šablona FLICKR) |
(+ GRaf) |
||
| Řádka 71: | Řádka 71: | ||
Za běžných teplot panujících na Zemi je tato rovnováha posunuta téměř úplně vlevo, takže velké množství oxidu uhličitého je vázáno v uhličitanových horninách. Stoupne-li teplota zhruba nad 350 °C, rovnováha se vychýlí téměř úplně vpravo a oxid křemičitý vytěsní z hornin oxid uhličitý, který přejde do atmosféry. Tímto mechanismem se vysvětluje velmi hustá atmosféra planety [[Venuše (planeta)|Venuše]], složená převážně z oxidu uhličitého. | Za běžných teplot panujících na Zemi je tato rovnováha posunuta téměř úplně vlevo, takže velké množství oxidu uhličitého je vázáno v uhličitanových horninách. Stoupne-li teplota zhruba nad 350 °C, rovnováha se vychýlí téměř úplně vpravo a oxid křemičitý vytěsní z hornin oxid uhličitý, který přejde do atmosféry. Tímto mechanismem se vysvětluje velmi hustá atmosféra planety [[Venuše (planeta)|Venuše]], složená převážně z oxidu uhličitého. | ||
Při ochlazení pod -80 °C mění plynný oxid uhličitý svoje [[skupenství]] přímo na pevné ([[sublimace|desublimuje]]) za vzniku bezbarvé tuhé látky, nazývané ''suchý led''. | Při ochlazení pod -80 °C mění plynný oxid uhličitý svoje [[skupenství]] přímo na pevné ([[sublimace|desublimuje]]) za vzniku bezbarvé tuhé látky, nazývané ''suchý led''. | ||
| - | [[Soubor: | + | [[Soubor:Fázový diagram tlak-teplota pro oxid uhličitý.png|thumb|200px|Fázový diagram oxidu uhličitého]] |
Oxid uhličitý je nedýchatelný a ve vyšších koncentracích může způsobit ztrátu vědomí a smrt. Naruší totiž uhličitanovou rovnováhu v krvi a způsobí tak acidosu. Stejně tak ovšem pokles pod jeho normální koncentraci může způsobit alkalosu. | Oxid uhličitý je nedýchatelný a ve vyšších koncentracích může způsobit ztrátu vědomí a smrt. Naruší totiž uhličitanovou rovnováhu v krvi a způsobí tak acidosu. Stejně tak ovšem pokles pod jeho normální koncentraci může způsobit alkalosu. | ||
== Výskyt v přírodě == | == Výskyt v přírodě == | ||
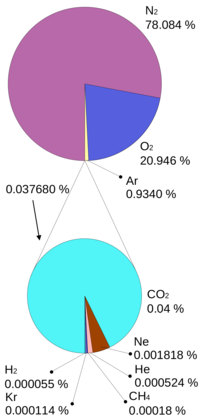
| - | [[Soubor:Atmosphere_gas_proportions.png|thumb| | + | [[Soubor:Atmosphere_gas_proportions.png|thumb|200px|Horní koláčový graf ukazuje složení suchého vzduchu. Oxid uhličitý představuje azurový podíl dolního grafu]] |
Oxid uhličitý je běžnou součástí zemské atmosféry, přičemž jeho koncentrace (průměrně 0,038 % v roce [[2004]]) v ovzduší kolísá v závislosti na místních podmínkách, na výšce nad povrchem a relativní vlhkosti vzduchu v ovzduší. V důsledku zejména průmyslových emisí jeho průměrná koncentrace ve vzduchu stále roste (viz odstavec „Vliv oxidu uhličitého na globální oteplování“). | Oxid uhličitý je běžnou součástí zemské atmosféry, přičemž jeho koncentrace (průměrně 0,038 % v roce [[2004]]) v ovzduší kolísá v závislosti na místních podmínkách, na výšce nad povrchem a relativní vlhkosti vzduchu v ovzduší. V důsledku zejména průmyslových emisí jeho průměrná koncentrace ve vzduchu stále roste (viz odstavec „Vliv oxidu uhličitého na globální oteplování“). | ||
Lokálně velmi vysoká koncentrace je v místech jeho výronu [[sopečné plyny|sopečných plynů]] ze země ve [[vulkanismus|vulkanicky aktivních oblastech]] a v některých přírodních [[minerální voda|minerálních vodách]]. Vzhledem k tomu, že je těžší než vzduch může se v takových místech hromadit a představovat nebezpečnou past pro zvířata i lidi. Ročně tak vulkanické aktivity dodávají do ovzduší Země přibližně 130 až 230 [[gram|Tg]], což představuje řádově jen 1 až 2 % produkce CO<sub>2</sub> lidstvem. | Lokálně velmi vysoká koncentrace je v místech jeho výronu [[sopečné plyny|sopečných plynů]] ze země ve [[vulkanismus|vulkanicky aktivních oblastech]] a v některých přírodních [[minerální voda|minerálních vodách]]. Vzhledem k tomu, že je těžší než vzduch může se v takových místech hromadit a představovat nebezpečnou past pro zvířata i lidi. Ročně tak vulkanické aktivity dodávají do ovzduší Země přibližně 130 až 230 [[gram|Tg]], což představuje řádově jen 1 až 2 % produkce CO<sub>2</sub> lidstvem. | ||
Aktuální verze z 2. 12. 2014, 09:06
Oxid uhličitý, archaicky uhlec, je bezbarvý plyn bez chuti a zápachu; při vyšších koncentracích může v ústech mít slabě nakyslou chuť. Je těžší než vzduch. Vzniká reakcí uhlíku s kyslíkem (spalováním):
- C + O2 → CO2,
hořením oxidu uhelnatého (například svítiplynu):
- 2 CO + O2 → 2 CO2,
nebo organických látek, například methanu:
- CH4 + 2 O2 → CO2 + 2 H2O,
a to vždy za vývinu značného množství tepla. Podobnými reakcemi můžeme popsat i spalování fosilních paliv a biomasy. Je také produktem dýchání většiny živých organismů, kde je spolu s vodou konečným produktem metabolické přeměny živin obsažených v potravě. V laboratoři se většinou připravuje reakcí uhličitanů, především uhličitanu vápenatého se silnými kyselinami například chlorovodíkovou:
- CaCO3 + 2 HCl → CO2 + CaCl2 + H2O.
Průmyslově se vyrábí tepelným rozkladem (žíháním) vápence (uhličitanu vápenatého):
- CaCO3 → CaO + CO2.
Po chemické stránce je oxid uhličitý velice stálý a ani při velmi vysokých teplotách nad 2 000 °C se znatelně nerozkládá. Ve vodě se snadno rozpouští, přičemž se přitom zčásti (asi z 0,003 %) slučuje s vodou na kyselinu uhličitou:
- CO2 + H2O ↔ H2CO3.
Oxid uhličitý reaguje se silnými hydroxidy za vzniku solí, které se vyskytují ve dvou formách, jako uhličitany a hydrogenuhličitany (starším názvem kyselé uhličitany); například s hydroxidem sodným vzniká buď hydrogenuhličitan sodný:
- CO2 + NaOH → NaHCO3,
nebo při větším množství hydroxidu uhličitan sodný:
- CO2 + 2 NaOH → Na2CO3 + H2O.
V zelených rostlinách je oxid uhličitý asimilován v procesu zvaném fotosyntéza za katalytického působení chlorofylu a dodávky energie ve formě světelných kvant na monosacharidy podle celkové rovnice:
- 6 CO2 + 6 H2O → C6H12O6 + 6 O2.
Spalování sacharidů v těle živočichů (i rostlin v noci) je chemickým procesem právě opačným, stejně tak kvašení cukrů působením kvasinek. Při geologickém vývoji planetárních těles hraje v chemismu oxidu uhličitého významnou roli rovnováha mezi oxidem uhličitým a oxidem křemičitým v kompetici o vápník podle vztahu:
- CaCO3 + SiO2 ↔ CO2 + CaSiO3.
Za běžných teplot panujících na Zemi je tato rovnováha posunuta téměř úplně vlevo, takže velké množství oxidu uhličitého je vázáno v uhličitanových horninách. Stoupne-li teplota zhruba nad 350 °C, rovnováha se vychýlí téměř úplně vpravo a oxid křemičitý vytěsní z hornin oxid uhličitý, který přejde do atmosféry. Tímto mechanismem se vysvětluje velmi hustá atmosféra planety Venuše, složená převážně z oxidu uhličitého. Při ochlazení pod -80 °C mění plynný oxid uhličitý svoje skupenství přímo na pevné (desublimuje) za vzniku bezbarvé tuhé látky, nazývané suchý led.
Oxid uhličitý je nedýchatelný a ve vyšších koncentracích může způsobit ztrátu vědomí a smrt. Naruší totiž uhličitanovou rovnováhu v krvi a způsobí tak acidosu. Stejně tak ovšem pokles pod jeho normální koncentraci může způsobit alkalosu.
Obsah |
Výskyt v přírodě
Oxid uhličitý je běžnou součástí zemské atmosféry, přičemž jeho koncentrace (průměrně 0,038 % v roce 2004) v ovzduší kolísá v závislosti na místních podmínkách, na výšce nad povrchem a relativní vlhkosti vzduchu v ovzduší. V důsledku zejména průmyslových emisí jeho průměrná koncentrace ve vzduchu stále roste (viz odstavec „Vliv oxidu uhličitého na globální oteplování“). Lokálně velmi vysoká koncentrace je v místech jeho výronu sopečných plynů ze země ve vulkanicky aktivních oblastech a v některých přírodních minerálních vodách. Vzhledem k tomu, že je těžší než vzduch může se v takových místech hromadit a představovat nebezpečnou past pro zvířata i lidi. Ročně tak vulkanické aktivity dodávají do ovzduší Země přibližně 130 až 230 Tg, což představuje řádově jen 1 až 2 % produkce CO2 lidstvem. Oxid uhličitý byl také nalezen v mezihvězdném prostoru. Je hlavní složkou atmosfér planet Venuše a Mars. Spektroskopicky byl prokázán i v řadě komet.
Využití
Oxid uhličitý je průmyslově lehce dostupný plyn. Využívá se jako:
- chemická surovina pro výrobu:
- anorganických uhličitanů
- methanolu
- polykarbonátů
- polyuretanů
- karbamátů
- isokyanátů
- a jiných organických sloučenin
- hnací plyn a ochranná atmosféra pro potravinářské účely
- součást perlivých nápojů
- náplň sněhových hasicích přístrojů
- chladicí médium (suchý led)
- v medicíně se přidává (do 5 %) ke kyslíku pro zvýšení efektivity dýchání
- hnojivo v akvaristice
Vliv oxidu uhličitého na globální oteplování
Oxid uhličitý se podílí na vzniku skleníkového efektu. Největší podíl na skleníkovém efektu však překvapivě nemá oxid uhličitý ale vodní pára[1][2], která se na něm podílí z více než 60 procent[3]. Jeho nárůst v ovzduší, což je považováno za hlavní příčinu globálního oteplování, je způsoben zejména spalováním fosilních paliv a úbytkem lesů. Naštěstí zatím nejvýkonnější ekosystém poutající vzdušný oxid uhličitý - mořský fytoplankton - není dosud příliš narušen. Velké množství oxidu uhličitého je také rozpuštěno ve světových mořích a oceánech, které tak regulují jeho množství v atmosféře. Pozvolný nárůst globální teploty však negativně ovlivňuje rozpustnost CO2 v mořské vodě a pozitivní zpětnou vazbou se tak dostává zpět do vzduchu další dodatečné množství tohoto skleníkového plynu. Naštěstí většina oxidu uhličitého je v mořské vodě vázána chemicky ve formě uhličitanových a hydrogenuhličitanových iontů, za což vděčíme jeho reakci s vápenatými minerály podle rovnice:
- CaCO3 + CO2 + H2O ←→ Ca2+ + 2 HCO3-
Tato rovnováha se však se zvyšující teplotou posunuje doleva. Také intenzita fotosyntézy fytoplanktonem je závislá na optimální teplotě a s jejím růstem nad optimum klesá.
Oxid uhličitý a biomasa
Kromě spalování biomasy či bioplynu vzniká oxid uhličitý také během kompostování. Navíc část organické hmoty zůstává na poli jako posklizňové (potěžební) zbytky, a kořenový systém. V průběhu anaerobní digesce a kompostování je velká část organické hmoty přeměněna na stabilizované organo-minerální hnojivo s vysokým podílem humusových látek, takže velký podíl uhlíku zůstává dlouhodobě fixován v humusu, který zlepšuje vlastnosti půd (vododržnost, pufrační kapacitu, …). Navíc zlepšené vlastnosti půdy mají za následek vyšší výnosy, a tedy i intenzivnější asimilaci CO2 během fotosyntézy.
Historická poznámka
Oxid uhličitý byl první chemickou sloučeninou, která byla popsána jako plyn odlišný od vzduchu. V 17. století vlámský chemik Jan Baptist van Helmont zjistil, že při spalování dřevěného uhlí v uzavřené nádobě váha zbylého popele je menší, než původního uhlí. Vysvětlil to přeměnou části uhlí na neviditelnou substanci, kterou nazval plyn spiritus sylvestre.
V polovině 18. století vlastnosti tohoto plynu studoval podrobněji skotský lékař Joseph Black. Zjistil, že zahříváním vápence nebo jeho reakcí s kyselinami vzniká plyn, který nazval „fixovatelný vzduch“ („fixed air“), protože jej bylo možno vázat silnými zásadami (například hydroxidem vápenatým). Zjistil také, že je těžší než vzduch a že na rozdíl od normálního vzduchu nepodporuje hoření a že zvířata v něm hynou. Vázání na hydroxid vápenatý použil k důkazu, že je ve vydechovaném vzduchu a také, že se uvolňuje při procesu kvašení (fermentace).
Toxikologické hledisko
Koncentrace oxidu uhličitého ve vdechovaném vzduchu od 10 % výše má za následek rychlou ztrátu vědomí a při delší expozici smrt. Nebezpečí hrozí například v silážních či kanalizačních prostorech.[4]
Literatura
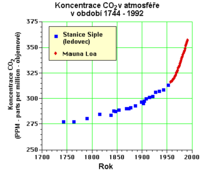
- Neftel, A., H. Friedli, E. Moore, H. Lotscher, H. Oeschger, U. Siegenthaler, and B. Stauffer. 1994. Historical carbon dioxide record from the Siple Station ice core. pp. 11-14. In T.A. Boden, D.P. Kaiser, R.J. Sepanski, and F.W. Stoss (eds.) Trends'93: A Compendium of Data on Global Change. ORNL/CDIAC-65. Carbon Dioxide Information Analysis Center, Oak Ridge National Laboratory, Oak Ridge, Tenn. U.S.A.
- Keeling, C.D., and T.P. Whorf. 1994. Atmospheric carbon dioxide records from sites in the SIO air sampling network. pp. 16-26. In T.A. Boden, D.P. Kaiser, R.J. Sepanski, and F.W. Stoss (eds.) Trends'93: A Compendium of Data on Global Change. ORNL/CDIAC-65. Carbon Dioxide Information Analysis Center, Oak Ridge National Laboratory, Oak Ridge, Tenn. U.S.A.
- WALTER, Carsten, STUPAVSKÝ, Vladimír: Velký CO2 podvod. Biom.cz [online]. 2008-12-15 [cit. 2009-06-09]. Dostupné z WWW: <http://biom.cz/cz/odborne-clanky/velky-co2-podvod>. ISSN: 1801-2655.
- NÁTR, Lubomír. 2006. Země jako skleník : proč s bát CO2?. vydala Academia, ISBN:80-200-1362-8
Reference
- ↑ http://www.fi.muni.cz/~tomp/envi/eseje/vymola/esej.doc
- ↑ http://www.cenia.cz/www/webapp.nsf/webfiles/files-TT-sklen.%20efekt.pdf/$FILE/sklen.%20efekt.pdf
- ↑ Nátr L.: Země jako skleník, kapitola 4.4 na str. 53
- ↑ Bardoděj, Z.: Chemie v hygieně a toxikologii. LFH UK, Praha 1988.
Externí odkazy
- Emise oxidu uhličitého podle zemí, v absolutních číslech,na 1000 obyvatel.
- Oxid uhličitý a další skleníkové plyny
|
|
| Oxidy s prvkem v oxidačním čísle IV. |
|---|
|
Oxid americičitý (AmO2) • Oxid uhličitý (CO2) • Oxid ceričitý (CeO2) • Oxid chloričitý (ClO2) • Oxid chromičitý (CrO2) • Oxid dusičitý (NO2) • Oxid germaničitý (GeO2) • Oxid hafničitý (HfO2) • Oxid neptuničitý (NpO2) • Oxid olovičitý (PbO2) • Oxid manganičitý (MnO2) • Oxid osmičitý (OsO2) • Oxid plutoničitý (PuO2) • Oxid protaktiničitý (PaO2) • Oxid rutheničitý (RuO2) • Oxid seleničitý (SeO2) • Oxid křemičitý (SiO2) • Oxid siřičitý (SO2) • Oxid telluričitý (TeO2) • Oxid thoričitý (ThO2) • Oxid cíničitý (SnO2) • Oxid titaničitý (TiO2) • Oxid wolframičitý (WO2) • Oxid uraničitý (UO2) • Oxid vanadičitý (VO2) • Oxid zirkoničitý (ZrO2) |
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |