The final launch of the Allmultimedia.org will take place on February 24, 2026
(shortly after the 2026 Winter Olympics).
Dovolená : 23. prosinec 2025 — 29. prosinec 2025
Holidays : December 23, 2025 — December 29, 2025
Mangan
Z Multimediaexpo.cz
m (1 revizi) |
(+ Vzhled) |
||
| Řádka 22: | Řádka 22: | ||
|[[Teplota varu]]||2061 °C, (2334 K) | |[[Teplota varu]]||2061 °C, (2334 K) | ||
|- | |- | ||
| - | |Vzhled||[[Soubor: | + | |Vzhled||[[Soubor:Macro image of manganese f22.0.JPG|200px|Mangan (99.99 %)]] |
|- | |- | ||
|[[Elektronegativita]] (Pauling)|| 1,55 | |[[Elektronegativita]] (Pauling)|| 1,55 | ||
| Řádka 77: | Řádka 77: | ||
== Výskyt == | == Výskyt == | ||
| - | [[Soubor:PyrolusiteUSGOV.jpg | + | [[Soubor:PyrolusiteUSGOV.jpg|200px|thumb|Manganová ruda - burel MnO<sub>2</sub>]] |
| - | [[Soubor:ManganiteUSGOV.jpg | + | [[Soubor:ManganiteUSGOV.jpg|thumb|200px|Manganová ruda - manganit MnO(OH)]] |
Mangan je prvkem s poměrně značným zastoupením na [[Země|Zemi]] i ve vesmíru. V [[zemská kůra|zemské kůře]] činí průměrný obsah manganu kolem 0,9 – 1 g/kg, což odpovídá 0,1% nebo 1000 ppm (''parts per milion'' = počet částic na 1 milion částic) a ve výskytu na Zemi se řadí na dvanácté místo. Mangan je po [[železo|železe]] a [[Titan (prvek)|titanu]] třetí nejrozšířenější [[kov]] na Zemi. V mořské [[voda|vodě]] se jeho koncentrace pohybuje na úrovni 2 mikrogramů v jednom litru. Předpokládá se, že ve [[vesmír]]u připadá na jeden atom manganu přibližně 5 milionů atomů [[vodík]]u. | Mangan je prvkem s poměrně značným zastoupením na [[Země|Zemi]] i ve vesmíru. V [[zemská kůra|zemské kůře]] činí průměrný obsah manganu kolem 0,9 – 1 g/kg, což odpovídá 0,1% nebo 1000 ppm (''parts per milion'' = počet částic na 1 milion částic) a ve výskytu na Zemi se řadí na dvanácté místo. Mangan je po [[železo|železe]] a [[Titan (prvek)|titanu]] třetí nejrozšířenější [[kov]] na Zemi. V mořské [[voda|vodě]] se jeho koncentrace pohybuje na úrovni 2 mikrogramů v jednom litru. Předpokládá se, že ve [[vesmír]]u připadá na jeden atom manganu přibližně 5 milionů atomů [[vodík]]u. | ||
V přírodě se mangan vyskytuje prakticky vždy současně s rudami železa. Hlavním minerálem manganu je '''''[[pyroluzit]]''''' ('''''burel''''') MnO<sub>2</sub>, další významnější nerosty jsou '''''[[hausmannit]]''''' Mn<sub>3</sub>O<sub>4</sub>, '''''[[braunit]]''''' Mn<sub>2</sub>O<sub>3</sub>, '''''[[manganit]]''''' MnO(OH) a '''''[[rhodochrozit]]''''' neboli '''''[[dialogit]]''''' MnCO<sub>3</sub>. Méně významné minerály jsou například '''''[[wolframit]]''''' (Fe,Mn)WO<sub>4</sub>, '''''[[triplit]]''''' (Mn,Fe<sup>2+</sup>)<sub>2</sub>(PO<sub>4</sub>)(F,OH), '''''[[tephroit]]''''' Mn<sub>2</sub>SiO<sub>4</sub>, '''''[[tantalit]]''''', [(Fe, Mn) Ta<sub>2</sub>O<sub>6</sub>]. | V přírodě se mangan vyskytuje prakticky vždy současně s rudami železa. Hlavním minerálem manganu je '''''[[pyroluzit]]''''' ('''''burel''''') MnO<sub>2</sub>, další významnější nerosty jsou '''''[[hausmannit]]''''' Mn<sub>3</sub>O<sub>4</sub>, '''''[[braunit]]''''' Mn<sub>2</sub>O<sub>3</sub>, '''''[[manganit]]''''' MnO(OH) a '''''[[rhodochrozit]]''''' neboli '''''[[dialogit]]''''' MnCO<sub>3</sub>. Méně významné minerály jsou například '''''[[wolframit]]''''' (Fe,Mn)WO<sub>4</sub>, '''''[[triplit]]''''' (Mn,Fe<sup>2+</sup>)<sub>2</sub>(PO<sub>4</sub>)(F,OH), '''''[[tephroit]]''''' Mn<sub>2</sub>SiO<sub>4</sub>, '''''[[tantalit]]''''', [(Fe, Mn) Ta<sub>2</sub>O<sub>6</sub>]. | ||
| Řádka 122: | Řádka 122: | ||
==== Sloučeniny manganaté Mn<sup>2+</sup> ==== | ==== Sloučeniny manganaté Mn<sup>2+</sup> ==== | ||
| - | [[Soubor:Manganese(II) chloride tetrahydrate.jpg|thumb | + | [[Soubor:Manganese(II) chloride tetrahydrate.jpg|thumb|200px|Chlorid manganatý]] |
| - | [[Soubor:Manganese(II)-sulfate-photo.jpg|thumb | + | [[Soubor:Manganese(II)-sulfate-photo.jpg|thumb|200px|Síran manganatý]] |
Soli dvojmocného manganu Mn<sup>+2</sup> jsou jak v bezvodém stavu tak i v roztoku narůžovělé. Na [[vzduch]]u a v roztoku za přítomnosti nadbytečné [[kyselina|kyseliny]] jsou stálé. V zásaditém prostředí vzniká [[hydroxid manganatý]], který je nestabilní. Také v neutrálních roztocích při delším stání nejsou manganaté soli úplně stálé, ale oxidují se na soli manganité a [[oxid manganičitý]]. Soli manganaté jsou většinou dobře rozpustné ve vodě a vytváří také [[podvojné sloučeniny]]. | Soli dvojmocného manganu Mn<sup>+2</sup> jsou jak v bezvodém stavu tak i v roztoku narůžovělé. Na [[vzduch]]u a v roztoku za přítomnosti nadbytečné [[kyselina|kyseliny]] jsou stálé. V zásaditém prostředí vzniká [[hydroxid manganatý]], který je nestabilní. Také v neutrálních roztocích při delším stání nejsou manganaté soli úplně stálé, ale oxidují se na soli manganité a [[oxid manganičitý]]. Soli manganaté jsou většinou dobře rozpustné ve vodě a vytváří také [[podvojné sloučeniny]]. | ||
* [[Oxid manganatý]] MnO je zelenošedý až trávově zelený prášek. Jemně rozptýlený prášek se snadno oxiduje. [[Oxid manganatý]] se v přírodě vyskytuje velmi vzácně jako nerost '''''[[manganosit]]'''''. [[Oxid manganatý]] se připravuje redukcí vyšších [[oxid]]ů [[vodík]]em nebo [[oxid uhelnatý|oxidem uhelnatým]]. | * [[Oxid manganatý]] MnO je zelenošedý až trávově zelený prášek. Jemně rozptýlený prášek se snadno oxiduje. [[Oxid manganatý]] se v přírodě vyskytuje velmi vzácně jako nerost '''''[[manganosit]]'''''. [[Oxid manganatý]] se připravuje redukcí vyšších [[oxid]]ů [[vodík]]em nebo [[oxid uhelnatý|oxidem uhelnatým]]. | ||
| Řádka 146: | Řádka 146: | ||
==== Sloučeniny manganičité Mn<sup>4+</sup> ==== | ==== Sloučeniny manganičité Mn<sup>4+</sup> ==== | ||
| - | [[Soubor:Manganese(IV) oxide.jpg|thumb | + | [[Soubor:Manganese(IV) oxide.jpg|thumb|200px|Oxid manganičitý]] |
Ze sloučenin Mn<sup>+4</sup> má největší praktický význam '''''[[burel]]'''''. Burel je velmi stabilní, ale manganičité soli jsou velmi málo stabilní. Většinou jsou známy pouze komplexní sloučeniny. K velmi stabilním sloučeninám patří komplexní manganičitany - [[acidomanganičitany]] (viz níže). | Ze sloučenin Mn<sup>+4</sup> má největší praktický význam '''''[[burel]]'''''. Burel je velmi stabilní, ale manganičité soli jsou velmi málo stabilní. Většinou jsou známy pouze komplexní sloučeniny. K velmi stabilním sloučeninám patří komplexní manganičitany - [[acidomanganičitany]] (viz níže). | ||
* [[Oxid manganičitý]] neboli [[burel]] MnO<sub>2</sub> je šedý, ve vodě nerozpustný prášek se slabě [[oxidace|oxidačními]] vlastnostmi. V přírodě se nachází jako nerost '''''[[pyrolusit]]''''', '''''[[polianit]]''''', šedý '''''[[burel]]''''', '''''[[psilomelan]]''''', '''''[[waad]]''''' neboli ''manganová pěna'' a '''''[[manganová čerň]]'''''. Uměle připravený burel s vyskytuje ve třech modifikacích. Jeho uplatnění při výrobě galvanických článků je popsáno výše, v laboratorním měřítku se používá jako činidlo pro přípravu malých množství plynného [[Chlór|chloru]]. Hydratovaný [[oxid manganičitý]] je hnědá až načernalá, amfoterní látka. Vzniká oxidací manganatých iontů nebo redukcí [[manganan]]ů či [[manganistan]]ů. | * [[Oxid manganičitý]] neboli [[burel]] MnO<sub>2</sub> je šedý, ve vodě nerozpustný prášek se slabě [[oxidace|oxidačními]] vlastnostmi. V přírodě se nachází jako nerost '''''[[pyrolusit]]''''', '''''[[polianit]]''''', šedý '''''[[burel]]''''', '''''[[psilomelan]]''''', '''''[[waad]]''''' neboli ''manganová pěna'' a '''''[[manganová čerň]]'''''. Uměle připravený burel s vyskytuje ve třech modifikacích. Jeho uplatnění při výrobě galvanických článků je popsáno výše, v laboratorním měřítku se používá jako činidlo pro přípravu malých množství plynného [[Chlór|chloru]]. Hydratovaný [[oxid manganičitý]] je hnědá až načernalá, amfoterní látka. Vzniká oxidací manganatých iontů nebo redukcí [[manganan]]ů či [[manganistan]]ů. | ||
| Řádka 160: | Řádka 160: | ||
==== Sloučeniny manganisté Mn<sup>7+</sup> ==== | ==== Sloučeniny manganisté Mn<sup>7+</sup> ==== | ||
| - | [[Soubor:Kaliumperma.jpg | + | [[Soubor:Kaliumperma.jpg|200px|thumb|Krystalický manganistan draselný]] |
V běžném životě se patrně nejčastěji setkáme se sloučeninami sedmimocného manganu - [[manganistany]]. Manganistany se připravují oxidací mangananů. | V běžném životě se patrně nejčastěji setkáme se sloučeninami sedmimocného manganu - [[manganistany]]. Manganistany se připravují oxidací mangananů. | ||
* [[Oxid manganistý]] Mn<sub>2</sub>O<sub>7</sub> je těžký olej, tmavý se zelenožlutým leskem. Při zahřívání vybuchuje a rozkládá se [[oxid manganičitý]] a [[kyslík]]. Ve vodě se rozpouští za vzniku [[kyselina manganistá|kyseliny manganisté]]. Připravuje se dehydratací [[manganistan draselný|manganistanu draselného]] koncentrovanou [[kyselina sírová|kyselinou sírovou]]. | * [[Oxid manganistý]] Mn<sub>2</sub>O<sub>7</sub> je těžký olej, tmavý se zelenožlutým leskem. Při zahřívání vybuchuje a rozkládá se [[oxid manganičitý]] a [[kyslík]]. Ve vodě se rozpouští za vzniku [[kyselina manganistá|kyseliny manganisté]]. Připravuje se dehydratací [[manganistan draselný|manganistanu draselného]] koncentrovanou [[kyselina sírová|kyselinou sírovou]]. | ||
| Řádka 218: | Řádka 218: | ||
* Periodická tabulka prvků [http://www.tabulka.cz/] | * Periodická tabulka prvků [http://www.tabulka.cz/] | ||
| - | {{Tabulka prvků}} | + | {{Tabulka prvků}}{{Flickr|Manganese}}{{Commonscat|Manganese}}{{Článek z Wikipedie}} |
| - | {{Commonscat|Manganese}}{{Článek z Wikipedie}} | + | |
[[Kategorie:Chemické prvky]] | [[Kategorie:Chemické prvky]] | ||
[[Kategorie:Kovy]] | [[Kategorie:Kovy]] | ||
Aktuální verze z 24. 1. 2017, 11:14
| Mangan | |
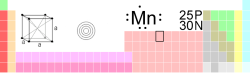
| |
| Atomové číslo | 25 |
| Relativní atomová hmotnost | 54,938045(5) amu |
| Elektronová konfigurace | [Ar] 3d5 4s2 |
| Elektronegativita | 1,5 |
| Počet přírodních izotopů | 1 |
| Skupenství | Pevné |
| Oxidační čísla | Mn-3, Mn-2, Mn-, Mn0, Mn+, Mn2+, Mn3+, Mn4+, Mn5+, Mn6+, Mn7+ |
| Teplota tání | 1246 °C, (1519 K) |
| Teplota varu | 2061 °C, (2334 K) |
| Vzhled | 
|
| Elektronegativita (Pauling) | 1,55 |
| Hustota | 7,21 g/cm3 |
| Hustota při teplotě tání | 5,95 g/cm3 |
| Tvrdost | 6 |
| Registrační číslo CAS | 7439-96-5 |
| Atomový poloměr | 1,295 Å (1,295*10-10m) |
| Iontový poloměr Mn2+ | 0,91 Å (0,91*10-10m) |
| Iontový poloměr Mn3+ | 0,69 Å (0,69*10-10m) |
| Iontový poloměr Mn4+ | 0,52 Å (0,52*10-10m) |
| Iontový poloměr Mn5+ | 0,33 Å (0,33*10-10m) |
| Iontový poloměr Mn6+ | 0,25 Å (0,25*10-10m) |
| Iontový poloměr Mn7+ | 0,46 Å (0,46*10-10m) |
| Specifické teplo | 0,1214 |
| Normální potenciál | -1,1 V |
| Skupenské teplo varu | 13,4 kJ/mol |
| Skupenské teplo tání | 221 kJ/mol |
| Měrný elektrický odpor při 20 °C | 0,185 mΩ |
Mangan, chemická značka Mn, (lat. Manganum) je světle šedý, paramagnetický, tvrdý kov. Používá se v metalurgii jako přísada do různých slitin, katalyzátorů a barevných pigmentů.
Obsah |
Základní fyzikálně - chemické vlastnosti
Kovový, křehký a značně tvrdý prvek světle šedé barvy. Patří mezi přechodné prvky, které mají valenční elektrony v d-sféře. Mangan je velmi elektropozitivní prvek, který je nejelektropozitivnější po alkalických kovech, kovech alkalických zemin a hliníku. Mangan se vyskytuje ve třech stabilních modifikacích (α-mangan, β-mangan a γ-mangan), které se mění v závislosti na teplotě. První modifikace je stabilní za obyčejné teploty, druhá je stabilní v rozmezí 742 °C až 1070 °C a třetí v rozmezí 1070 °C až 1160 °C. První dvě modifikace jsou křehké a tvrdé a vznikají při aluminotermické výrobě manganu a třetí vzniká při elektrolytickém vylučování manganu a je měkká a tažná. Čtvrtá, ale nestabilní modifikace manganu, vzniká při teplotě nad 1160 °C a označuje se jako δ-mangan. S rostoucím oxidačním číslem klesá zásaditost prvku a stoupá kyselost. Mangan se v některých svých vlastnostech i sloučeninách velmi podobá prvkům a sloučeninám sedmé hlavní podskupiny - halogenidům - zejména pak chloru ve svém nejvyšším oxidačním čísle - chloristany se velmi podobají manganistanům. Ve sloučeninách se vyskytuje především v řadě mocenství od Mn+1 po Mn+7. Nejstálejší jsou však sloučeniny manganu Mn+2, Mn+4 a Mn+7, ale snadno lze získat i sloučeniny s oxidačním číslem Mn+3, Mn+5 i Mn+6. V silných minerálních kyselinách je mangan rozpustný za vývoje plynného vodíku, v koncentrované kyselině sírové se rozpouští za vzniku oxidu siřičitého a v kyselině dusičné se podle její koncentrace rozpouští buď za vzniku oxidu dusnatého nebo oxidu dusičitého. Protože je chemicky poměrně podobný železu, je jeho odolnost vůči korozi nízká. Jemně rozetřený práškový mangan je pyroforický - je samozápalný na vzduchu. Mangan je také schopný rozkládat vodu a uvolňovat z ní vodík. Mangan je za normálních teplot málo reaktivní, ale za vyšší teploty se slučuje s mnoha prvky - fosfor, halogeny, dusík, síra, uhlík, křemík, bor a další.
Historický vývoj
Oxid manganičitý - burel - je znám již od starověku, kdy se používal při výrobě skla. Byl považován za odrůdu magnetovce (magnes). Římský filozof Plinius starší nazval burel jako „ženskou“ odrůdu magnetovce.
Středověk již rozlišoval rozdíl mezi magnes nebo magnesius lapis (magnetovec) a magnesia nebo pseudomagnes (falešný magnet čili burel). O něco později dali skláři burelu název podle jeho schopnosti odbarvovat železnaté sklo tzv. sklářské mýdlo a změnili jeho název na manganes neboli lapis manganensis.
Názor, že je burel železnou rudou, se udržel až do poloviny 18. století. V této době se však konečně došlo k názoru, že tato ruda musí obsahovat i jiný, dosud neznámý, kov. Objevil jej roku 1774 švédský chemik Carl W. Scheele, který předložil v tomto roce nezvratné důkazy Akademii věd ve Stockholmu.
V témže roce se podařilo mangan izolovat. Izoloval ho Johan Gottlieb Gahn při zahřívání burelu s dřevěným uhlím a olejem za vysoké teploty. Mangan v čisté podobě byl vyroben teprve ve třicátých letech dvacátého století elektrolýzou roztoků manganatých solí. Mangan dostal roku 1774 první název manganesium, ale později byl název změněn na mangan (latinsky manganum), aby se zabránilo záměně s hořčíkem (latinsky magnesium), který byl mezitím objeven.
Výskyt
Mangan je prvkem s poměrně značným zastoupením na Zemi i ve vesmíru. V zemské kůře činí průměrný obsah manganu kolem 0,9 – 1 g/kg, což odpovídá 0,1% nebo 1000 ppm (parts per milion = počet částic na 1 milion částic) a ve výskytu na Zemi se řadí na dvanácté místo. Mangan je po železe a titanu třetí nejrozšířenější kov na Zemi. V mořské vodě se jeho koncentrace pohybuje na úrovni 2 mikrogramů v jednom litru. Předpokládá se, že ve vesmíru připadá na jeden atom manganu přibližně 5 milionů atomů vodíku. V přírodě se mangan vyskytuje prakticky vždy současně s rudami železa. Hlavním minerálem manganu je pyroluzit (burel) MnO2, další významnější nerosty jsou hausmannit Mn3O4, braunit Mn2O3, manganit MnO(OH) a rhodochrozit neboli dialogit MnCO3. Méně významné minerály jsou například wolframit (Fe,Mn)WO4, triplit (Mn,Fe2+)2(PO4)(F,OH), tephroit Mn2SiO4, tantalit, [(Fe, Mn) Ta2O6]. Roční těžba manganových rud je přibližně 10 milionů tun a z toho se vytěží 3,4 mil. tun v Rusku, 2,13 mil. tun JAR, 1 mil. tun v Gabonu a Brazílii, 0,58 mil. tun v Austrálii a 0,5 mil. tun v Číně. V České republice se rudy manganu vyskytují v Krušných horách.
Velmi zajímavé objekty jsou manganové konkrece, což jsou kulovité útvary o velikosti od průměru několika centimetrů až velikost fotbalového míče, které se hojně vyskytují na některých místech oceánského dna. Byly objeveny v letech 1872 až 1876 na dně Tichého oceánu. Obvykle je jejich výskyt spojován s místy, kde se stýkají dvě různé oceánské desky. Na dně oceánů je více než 1012 tun manganových konkrecí a ročně se jich usadí řádově 107 tun. Konkrece vznikají při zvětrávání a následném vyplavování hornin do řek a následně oceánů, tam se na dně opět shlukují a vznikají kulovité útvary. Konkrece jsou složeny z řady sloučenin přechodných kovů, převládají v nich oxidy manganu. Tyto konkrece obsahují 15-30 % manganu, železo a v menší míře nikl, měď a kobalt. Rudy, které se používají k průmyslovému získávání kovů musí obsahovat nejméně 35%, z čehož vyplývá, že tyto rudy nejsou ekonomicky nejvhodnější.
- V 80. a 90. letech 20. století se dokonce vážně uvažovalo o možnosti těžby těchto rud, navzdory skutečnosti, že hloubka, ve která se konkrece nacházejí přesahuje obvykle 2 000 m. Na této těžbě se měla dokonce podílet i tehdejší ČSSR. Celosvětový pokles zájmu o tyto suroviny a tím i pokles jejich cen však tento projekt zastavil.
Výroba
Základem výroby manganu je redukce uhlíkem (koksem) ve vysoké peci:
- Mn3O4 + 4 C → 3 Mn + 4 CO
Protože je neekonomické oddělovat v rudě pouze složky s manganem, vzniká tímto postupem slitina Fe a Mn – ferromangan s obsahem manganu kolem 70 – 90% nebo zrcadlovina. Tato slitina je naprosto vyhovující pro další hutní zpracování při legování ocelí, protože v nich je železo přítomno jako hlavní složka. Mangan se získavá aluminotermicky redukcí kovovým hliníkem. Při výrobě se vychází z burelu, ale ten by s hliníkem reagoval přílliš prudce, a proto se musí nejprve převést na Mn3O4, který reguje klidněji. Reakce Mn3O4 s hliníkem probíhá podle rovnice:
- 3 Mn3O4 + 8 Al → 4 Al2O3 + 9 Mn
Zvláště čistý mangan se získává elektrolýzou roztoku síranu manganatého.
Využití
Podstatnou část světové těžby manganu se spotřebuje při výrobě oceli - je to asi 95% světové produkce manganu, dále manganového bronzu a slitin hliníku. Zbytek se spotřebuje ve sklářském a keramickém průmyslu a při výrobě chemikálií. Manganistan draselný je látka se silnými oxidačními vlastnostmi. Pro svou zdravotní nezávadnost jsou proto roztoky KMnO4 používány k dezinfekci potravin, např. masa nebo syrové zeleniny v rizikových oblastech. Nevýhodou dezinfekce roztoky manganistanu je vznikající tmavý burel, což brání použití manganistanu při dezinfekci textilií nebo bytových ploch. Oxidačních vlastností manganistanu se využívá také v pyrotechnice, kde slouží k přípravě směsí pro pohon raket a obecně jako zdroj kyslíku pro kontrolované hoření. Síran manganatý a chlorid manganatý se používají v barvířství, v tisku tkanin a k moření osiva. Chlorid manganatý se také využívá na výrobu sikativ pro fermaže.
Některé sloučeniny manganu se používaly a dnes ještě některé používají jako malířské barvy. K přírodním barvám manganu patří umbra a k umělým manganová hněď (zásaditý uhličitan manganatý), manganová běloba (uhličitan manganatý), manganová zeleň (někdy také kasselská zeleň) a permanentní violeť.
Slitiny
V ocelářském průmyslu slouží mangan především jako složka, která při tavbě na sebe váže síru a kyslík, které je nutno z kvalitní oceli odstranit. Slouží tedy jako desulfurační a deoxidační přísada, která převede vzniklé sloučeniny S a O do strusky a vyčistí tak taveninu. Po dokončení tavby však v oceli vždy určité procento elementárního manganu zůstává, v některých případech pouze jako nezreagovaný přebytek po odstranění S a O, někdy je obsah záměrně vyšší tak, aby bylo dosaženo jiných mechanických vlastností vyrobené oceli. Kromě manganu obsahují oceli vždy jako základní složku železo, chrom a obvykle nikl.
Nejběžnější a nejdůležitější slitinou manganu je ferromangan, který obsahuje 70-90% manganu a zbytek železa. Další slitina manganu je silikomangan, který obsahuje 65-70% manganu a zbytek křemíku, a zrcadlovina, která obsahuje 5-20% manganu. Další mimořádně důležitou slitinou s obsahem manganu je dural. Tento název označuje skupinu velmi lehkých a mechanicky odolných slitin na bázi hliníku a hořčíku s menším množstvím mědi a manganu. Heuslerovy slitiny objevil roku 1898 Friedrich Heusler. Heusler totiž objevil, že mangan tvoří s mnoha kovy - například hliníkem, cínem nebo antimonem - slitiny, které jsou ferromagnetické, aniž obsahují ferromagnetický kov. Zdá se, že v těchto slitinách vznikají intermetalické sloučeniny. Nejsilnější vlastnosti se dosáhnou pokud nejsou přítomny v čistém stavu, ale jako směsné krystaly.
Barvení skla a keramiky
Přídavek malého množství manganu do skloviny může zvýšit jasnost vyrobeného skla, protože odstraňuje zelenavý nádech, který po sobě ve skle zanechávají stopy železa.
U keramických materiálů nebo porcelánu se používá tzv., glazování, kdy je primárně vypálený střep pokryt vrstvou tekuté glazury, která jako barvicí pigmenty obsahuje většinou soli různých těžkých kovů. Opětným vypálením předmětu v peci se glazura stabilizuje ve formě různých směsných oxidů, křemičitanů a dalších solí, které trvale zbarví její povrch. Společně se solemi manganu se do glazur přidávají obvykle sloučeniny železa a výsledným efektem je hnědé až červeno-hnědé zabarvení.
Galvanické články
Nejstarší komerčně vyráběný elektrický galvanický článek (baterie) se skládal ze zinkové katody a anody, kterou tvořil grafitový váleček umístěný v pastě s vysokým obsahem oxidu manganičitého (burele) MnO2. Článek poskytuje napětí přibližně 1,5 V a při odběru proudu dochází k oxidaci elementárního zinku na Zn+2 a redukci manganu na Mn+2. V průběhu posledních desetiletí byly tyto články z velké části nahrazeny jinými typy, které poskytují vyšší výkon na jednotku vlastní hmotnosti a nehrozí u nich riziko korozního zničení, i když články obsahující burel se stále komerčně využívají.
Sloučeniny
Anorganické sloučeniny
Z mnoha sloučenin manganu jsou nejvýznamnější sloučeniny v mocenství Mn+2, Mn+4 a Mn+7. Většina sloučenin manganu je jen minimálně toxická a téměř všechny jsou barevné.
Sloučeniny manganaté Mn2+
Soli dvojmocného manganu Mn+2 jsou jak v bezvodém stavu tak i v roztoku narůžovělé. Na vzduchu a v roztoku za přítomnosti nadbytečné kyseliny jsou stálé. V zásaditém prostředí vzniká hydroxid manganatý, který je nestabilní. Také v neutrálních roztocích při delším stání nejsou manganaté soli úplně stálé, ale oxidují se na soli manganité a oxid manganičitý. Soli manganaté jsou většinou dobře rozpustné ve vodě a vytváří také podvojné sloučeniny.
- Oxid manganatý MnO je zelenošedý až trávově zelený prášek. Jemně rozptýlený prášek se snadno oxiduje. Oxid manganatý se v přírodě vyskytuje velmi vzácně jako nerost manganosit. Oxid manganatý se připravuje redukcí vyšších oxidů vodíkem nebo oxidem uhelnatým.
- Hydroxid manganatý Mn(OH)2 je v čerstvém stavu bílá látka, která na vzduchu hnědne až černá a je nerozpustná ve vodě. V přírodě se vyskyuje jako nerost pyrochroit. Připravuje se srážením roztoků manganatých solí alkalickým hydroxidem.
- Chlorid manganatý MnCl2 je v bezvodém stavu narůžovělá krystalická látka, která se velmi dobře rozpouští ve vodě. S jinými chloridy tvoří adiční i podvojné sloučeniny. Chlorid manganatý se připravuje rozpouštěním uhličitanu manganatého v kyselině chlorovodíkové nebo spálením kovového manganu v proudu chloru.
- Bromid manganatý MnBr2 a jodid manganatý MnI2 jsou narůžovělé krystalické látky, které se velmi dobře rozpouští ve vodě. Připravují se rozpouštěním uhličitanu manganatého v kyselině bromovodíkové popř. kyselině jodovodíkové.
- Fluorid manganatý MnF2 je narůžovělá, ve vodě málo rozpustná, krystalická látka. Tvoří podvojné a komplexní soli (viz níže). Připravuje s rozpouštěním uhličitanu manganatého v kyselině fluorovodíkové.
- Síran manganatý MnSO4 je v bezvodém stavu téměř bílý, z roztoku krystaluje krásně růžový pentahydrát označovaný jako manganatá skalice a je velmi dobře rozpustný ve vodě. Slouží jako výchozí surovina pro elektrolytickou přípravu čistého manganu. Připravuje se rozpouštěním oxidu manganičitého v horké koncentrované kyselině sírové nebo reakcí oxidu manganičitého se síranem železnatým.
- Uhličitan manganatý MnCO3 je v čistém stavu bílý prášek, ale z roztoků se obyčejně sráží hnědý zásaditý uhličitan manganatý, který je nerozpustný ve vodě. V přírodě se vyskytuje jako minerál dialogit. Připravuje se srážením manganatých solí alkalickým uhličitanem.
- Dusičnan manganatý Mn(NO3)2 je v čistém stavu bezbarvá, krystalická látka, velmi dobře rozpustná ve vodě a snadno tvořící podvojné sloučeniny. Získává se rozpouštěním uhličitanu manganatého v kyselině dusičné.
- Sulfid manganatý MnS je v čerstvém stavu růžová práškovitá látka, nerozpustná ve vodě. Zahříváním přechází ve stálejší zelenou modifikaci, která se v přírodě vyskytuje jako nerost alabandin. V přírodě se vyskytuje i disulfid manganatý MnS2 jako nerost hauerit. Sulfid manganatý se připravuje srážením roztoků manganatých solí alkalickým sulfidem nabo kyselinou sirovodíkovou.
- Kyanid manganatý Mn(CN)2 je nerozpustná látka, která se na vzduchu velmi snadno rozkládá. Stálejší jsou komplexní soli kyanidu manganatého - kyanomanganatany, o kterých je pojednáno níže v komplexních sloučeninách.
- Rhodanid manganatý Mn(SCN)2 je v podobě dihydrátu a trihydrátu žlutá a v podobě tetrahydrátu zelená krystalická látka. Při rozpouštění tetrahydrátu ve vodě se při zřeďování roztoku mění barva roztoku ze zelené do růžové. Rhodanid manganatý tvoří komplexní sloučeniny, o kterých je pojednáno níže v komplexních sloučeninách. Rhodanid manganatý se připravuje rozpouštěním uhličitanu manganatého v kyselině rhodanovodíkové.
Sloučeniny manganité Mn3+
Manganité soli nejsou pro mangan úplně typické, ale lze je získat redukcí manganičitých sloučenin nebo oxidací manganatých sloučenin. Manganité sloučeniny jsou stabilní a na vzduchu ani ve vodě se nerozkládají. Jsou většinou temně zbarveny a mají silný sklon k tvorbě komplexních sloučenin - někdy nejde soli získat v jiném stavu.
- Oxid manganitý Mn2O3 je černý amorfní prášek, nerozpustný ve vodě. V přírodě se vyskytuje jako nerost braunit. Získává se pražením oxidu manganičitého na vzduchu nebo žíháním manganatých solí na vzduchu.
- Manganová hněď je hydratovaný oxid manganitý Mn2O3.nH2O, má černohnědou barvu a je nerozpustný ve vodě. Připravuje se přidáváním chlorového vápna a vápenaté vody k roztokům chloridu manganatého. Kaštanově hnědá barva připravená mletím a pálením hydratovaného oxidu manganitého, hydratovaného oxidu železnatého a hydratovaného oxidu hlinitého se nazývá umbra.
- Chlorid manganitý MnCl3 je přítomen v temně hnědém roztoku, který vzniká při působením koncentrované kyseliny chlorovodíkové na oxid manganičitý. Nelze jej vyloučit z roztoku, ale lze získat komplexní soli - chloromanganitany (viz níže).
- Fluorid manganitý MnF3 je rubínově červená krystalická látka, dobře rozpustná ve vodě. Velmi dobře tvoří komplexní sloučeniny (viz níže). Fluorid manganitý se připravuje působením fluoru na jodid manganatý.
- Síran manganitý Mn2(SO4)3 je červená krystalická látka, velmi dobře rozpustná ve vodě, která snadno tvoří podvojné sloučeniny (kamence) s komplexním kationem [Mn(H2O)6]3+ a disulfatomanganitany s komplexním anionem (viz níže). Připravuje se rozpuštěním oxidu manganitého nebo hydroxidu manganitého ve studené, mírně koncentrované kyselině sírové.
Sloučeniny manganičité Mn4+
Ze sloučenin Mn+4 má největší praktický význam burel. Burel je velmi stabilní, ale manganičité soli jsou velmi málo stabilní. Většinou jsou známy pouze komplexní sloučeniny. K velmi stabilním sloučeninám patří komplexní manganičitany - acidomanganičitany (viz níže).
- Oxid manganičitý neboli burel MnO2 je šedý, ve vodě nerozpustný prášek se slabě oxidačními vlastnostmi. V přírodě se nachází jako nerost pyrolusit, polianit, šedý burel, psilomelan, waad neboli manganová pěna a manganová čerň. Uměle připravený burel s vyskytuje ve třech modifikacích. Jeho uplatnění při výrobě galvanických článků je popsáno výše, v laboratorním měřítku se používá jako činidlo pro přípravu malých množství plynného chloru. Hydratovaný oxid manganičitý je hnědá až načernalá, amfoterní látka. Vzniká oxidací manganatých iontů nebo redukcí mangananů či manganistanů.
- Manganičitan manganatý neboli oxid manganato-manganičitý Mn3O4 je červená, nerozpustná látka. V přírodě se vyskytuje jako nerost hausmannit. Připravuje se redukcí oxidu manganitého vodíkem.
- Síran manganičitý Mn(SO4)2 je černá krystalická látka. Stabilní v roztoku je pouze v prostředí 50-80 % kyseliny sírové, jinak se rozkládá na oxid manganičitý. Připravuje se oxidací síranu manganatého v prostředí kyseliny sírové manganistanem draselným při teplotě 50-60 °C.
Sloučeniny manganičnanové 5+
Při tavení oxidu manganičitého s dusičnanem a uhličitanem sodným se tvoří modré manganičnany alkalických kovů. Manganičnany lze také připravit žíháním libovolného oxidu manganu s oxidem barnatým při 900 °C. O něco později byly manganičnany používány jako nátěrová barva - manganová modř.
Sloučeniny manganové Mn6+
Manganové sloučeniny nejsou příliš stabilní a mají snahu se oxidovat na manganisté sloučeniny, stejně tak jako manganany, které mají v roztoku sytě zelenou barvu a okamžitě se vodou štěpí na manganistan a oxid manganičitý. Velmi rychle přechází v manganistany, jsou to tedy silná redukční činidla. Manganany se získávají při zahřívání oxidu manganičitého s dusičnanem nebo žíháním hydroxidu draselného s oxidem manganičitým za přístupu vzduchu.
Sloučeniny manganisté Mn7+
V běžném životě se patrně nejčastěji setkáme se sloučeninami sedmimocného manganu - manganistany. Manganistany se připravují oxidací mangananů.
- Oxid manganistý Mn2O7 je těžký olej, tmavý se zelenožlutým leskem. Při zahřívání vybuchuje a rozkládá se oxid manganičitý a kyslík. Ve vodě se rozpouští za vzniku kyseliny manganisté. Připravuje se dehydratací manganistanu draselného koncentrovanou kyselinou sírovou.
- Kyselina manganistá HMnO4 je látka známá pouze v roztoku, ve kterém má fialovou barvu. Je to velmi silná kyselina podobná kyselině chloristé. Kyselina manganistá se připravuje rozpouštěním oxidu manganistého ve vodě nebo zahříváním směsi manganaté soli s oxidem olovičitým v kyselém prostředí.
- Manganistan draselný KMnO4, hypermangan je fialová látka, která se velmi dobře rozpouští ve vodě. V analytické chemii jsou roztoky KMnO4 jedním ze základních oxidimetrických činidel pro redox- titrace. Při této titraci je analyzovaná látka v roztoku vzorku kvantitativně oxidována postupnými přesnými přídavky roztoku manganistanu do definovaného stádia a v okamžiku, kdy je celý vzorek zoxidován, odečte se objem spotřebovaného titračního roztoku a z tohoto údaje lze spočíst množství analyzované látky ve vzorku. Situace, kdy bylo dosaženo uvedené rovnováhy se nazývá bod ekvivalence a dosažení tohoto stavu je indikováno obvykle potenciometricky nebo i vizuálně za použití vhodného indikátoru.
Komplexní sloučeniny
Oxidační stav IV (d3)
Oxidační stav IV je nejvyšším oxidačním stavem manganu, ve kterém je schopen tvořit komplexy. Jejich počet je však malý - známé jsou tzv. acidomanganičitany [MnX6]2- a [MnX5]-, kde X= F, Cl, IO3 a CN. K zvláště stabilním sloučeninám patří chloromanganičitany a fluoromanganičitany.
Oxidační stav III (d4)
Komplexy s manganem s oxidačním číslem III mají ve vodném roztoku silné oxidační vlastnosti. Dochází k disproporciaci na MnIV (oxid manganičitý MnO2) a MnII. Kyslíkové donorové atomy však tento oxidační stupeň stabilizují. Např. bílý hydroxid manganatý Mn(OH)2 se působením vzdušného kyslíku rychle mění na hydratovaný Mn2O3 (dochází k hnědnutí sraženiny). Podobně vzniká i [Mn(acac)3] vzdušnou oxidací manganatých solí v přitomnosti penta-2,4-dionu (acetylacetonu, acac). Znám je také trihydrát oxalatomanganitanu draselného K3[Mn(C2O4)3] • 3 H2O. Ostatní anionty schopné koordinace (fosforečnan a síran) však ve vodném roztoku stabilizují MnII. Komplexy MnIII jsou většinou oktaedrické a vysokospinové. Nejdůležitější nízkospinový oktaedrický komplex je tmavě červený hexakyanomanganitý anion [Mn(CN)6]3-, který se připravuje proháněním vzduchu vodným roztokem obsahující Mn2+ a CN-. Také jsou známy komplexy [MnX5]2-, kde X = F, Cl (fluoromanganitany jsou tmavě červené). Sůl (bipyH2)2+[MnCl5]2- má tetragonálně pyramidální uspořádání koordinační sféry.
Oxidační stav II (d5)
V tomto oxidačním stavu tvoří mangan nejvíce komplexů. Stálost MnII vůči oxidaci i redukci je dána vlivem symetrické konfigurace d5. Vysokospinový stav ale neposkytuje žádnou stabilizační energii ligandového pole a proto konstanty stability jsou v porovnání se sousedními MII komplexy nižší. Nejtypičtější komplex je světle růžový hexaaqua-manganatý kation [Mn(H2O)6]2+. Patří k vysokospinovým oktaedrickým komplexům podobně jako manganaté komplexy s ethylendiaminem (en), chelatonem III (ethylendiamintetraoctová kyselina - EDTA) a šťavelovou kyselinou (C2O4). Nízkospinové komplexy tvoří dvojmocný mangan pouze s ligandy ležícimi ve spektrochemické řadě zcela napravo. K nejdůležitějším patří kyanidové komplexy. Oktaedrický modrofialový hexakyanomanganatanový anion [Mn(CN)6]4- se však v roztoku obsahujícím nadbytek CN- za přístupu kyslíku oxiduje na tmavě červený hexakyanomanganitanový anion [Mn(CN)6]3- (samotný kyanid manganitý není znám). Za nepřístupu vzduchu působením hliníkové krupice lze získat žluté kyanomangannany M5I[Mn(CN)6], které jsou v roztoku bezbarvé. Existují také komplexy se žlutozelenou barvou s tetraedrickým anionem [MnX4]2- (X = Cl-, Br-, I-). Lze je získat krystalizací z ethanolických roztoků.
Nižší oxidační stavy
Mangan je schopen vytvářet komplexy i s nižšími oxidačními čísly než MnII a MnIII. Komplexy (sice spíše organické) vytváří mangan i se zápornými oxidačními čísly. Nejběžnější organický komplex manganu je [Mn2(CO)10] dekakarbonyl dimanganu, který patří mezi karbonyly manganu. Mangan v něm má oxidační číslo Mn0. Tato sloučenina je výchozí látkou pro tvorbu dalších komplexních organických sloučenin manganu.
Organické sloučeniny
Nejběžnější organické sloučeniny manganu jsou organokovy manganu. Jde především o komplexní karbonylové sloučeniny (karbonyly manganu), o kterých je pojednáno výše. Tyto sloučeniny se připravují redukcí oxidu manganičitého (např. pomocí LiAlH4) za zvýšeného tlaku a obsahem CO v atmosféře.
- Octan manganatý Mn(C2H3O2)2 krystaluje z vodných roztoků jako červený tetrahydrát, který se velmi dobře rozpouští ve vodě. Používá se jako stimulační hnojivo, sikativ a jako přenašeč kyslíku. Připravuje se rozpouštěním uhličitanu manganatého v kyselině octové.
- Šťavelan manganatý MnC2O4 je v bezvodém stavu růžová, krystalická látka, dobře rozpustná ve vodě. V hydratované formě je šťavelan bílý a v roztoku snadno tvoří podvojné soli. Připravuje se rozpouštěním uhličitanu manganatého v kyselině šťavelové.
Biologický význam
Přítomnost malých množství manganu v organizmu a jeho pravidelný přísun v potravě je nezbytné pro jeho správnou funkci. Dlouhodobý nedostatek manganu v potravě vede především k problémům v cévním systému, protože dochází k nežádoucím změnám v metabolizmu cholesterolu a jeho zvýšenému ukládání na cévní stěnu. Tento jev v dlouhodobém měřítku značně zvyšuje riziko vzniku kardiovaskulárních chorob. Mangan je důležitý i pro správný metabolismus cukrů a jeho nedostatek může vést k nebezpečí onemocnění cukrovkou (diabetes melitus). Hlavními přirozenými zdroji manganu v potravě je rostlinná strava jako obilniny, hrášek, olivy, borůvky, špenát a ořechy. Doporučená denní dávka v potravě se pohybuje mezi 20 – 30 mg Mn denně.
Naopak přebytek manganu v potravě působí negativně především na nervovou soustavu a působí potíže podobné projevům Parkinsonovy nemoci. Dlouhodobá expozice vysokými dávkami manganu může podle některých údajů zapříčinit vznik Parkinsonovy nemoci. Rostliny přijímají mangan jako všechny minerály z půdního roztoku, kde se vyskytuje ve špatně rozpustných oxidech nebo dobře rozpustných chelátech. Cheláty jsou pro příjem píznivější. V rostlinách je mangan důležitou součástí komplexu rozkládajícího vody, který se účastní primární fáze fotosyntézy. Vyskytuje se také v superoxiddismutázaách. Nedostatek poškozuje chloroplasty a je příčinou chlorózy.
Literatura
- Cotton F.A., Wilkinson J.:Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973
- Holzbecher Z.:Analytická chemie, SNTL, Praha 1974
- Dr. Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- N. N. Greenwood - A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993 ISBN 80-85427-38-9
Externí odkazy
- Periodická soustava a tabulka vlastností prvků [1]
- Chemický vzdělávací portál [2]
- WebElements (anglicky) [3]
- Periodická tabulka prvků [4]
|
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |







